Test diagnostyczny (matura próbna) Grudzień 2024, Poziom rozszerzony (Formuła 2023) - Zadanie 7. (6 pkt)
Chlorek fosforu(V) o wzorze PCl5 ulega rozkładowi zgodnie z równaniem:
PCl5 (g) ⇄ PCl3 (g) + Cl2 (g) Δ𝐻 > 0
7.1. (0–4)
Do cylindrycznego reaktora z ruchomym tłokiem wprowadzono 25,0 g stałego chlorku fosforu(V) i wypompowano całe powietrze. Zawartość reaktora ogrzano do temperatury 260 °C, co początkowo spowodowało sublimację całego chlorku fosforu(V), a w dalszej kolejności jego rozkład termiczny. W układzie utrzymywano stałe ciśnienie równe 1013 hPa, natomiast zmianie ulegała objętość mieszaniny gazów w reaktorze. W chwili 𝑡 w układzie ustaliła się równowaga. Gęstość równowagowej mieszaniny gazów w reaktorze wynosiła 𝑑=2,63 g∙dm−3.
Oblicz wartość stężeniowej stałej równowagi reakcji dysocjacji termicznej chlorku fosforu(V) w temperaturze 260 °C. Przyjmij: R = 83,14 hPa ∙ dm3 ∙ mol–1 ∙ K–1, MPCl5 = 208,5 g ∙ mol–1, MPCl3 = 137,5 g ∙ mol–1.
7.2. (0–2)
Na poniższym wykresie przedstawiono zmianę stężenia molowego chlorku fosforu(V) PCl5 w trakcie – opisanej w informacji wstępnej – reakcji prowadzonej w temperaturze 260 °C.
Tę reakcję przeprowadzono ponownie w tym samym reaktorze. Zmieniono jedynie temperaturę, w której znajdował się układ – wynosiła ona 400 °C.
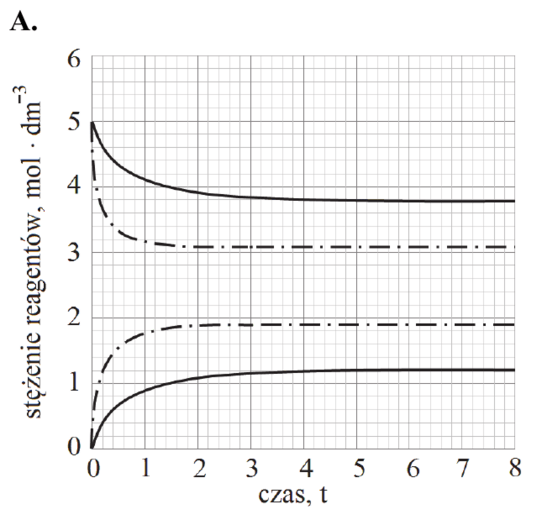
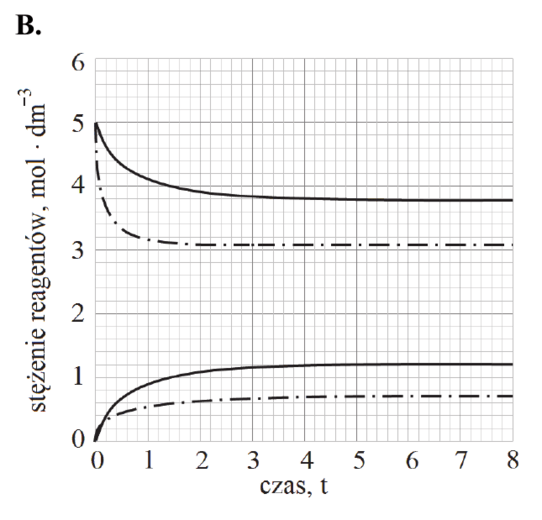
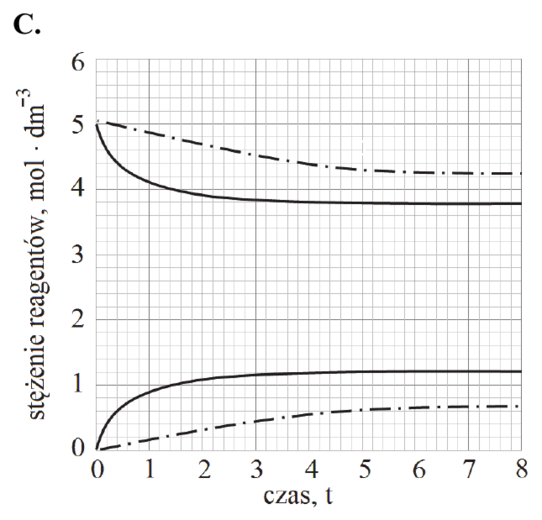
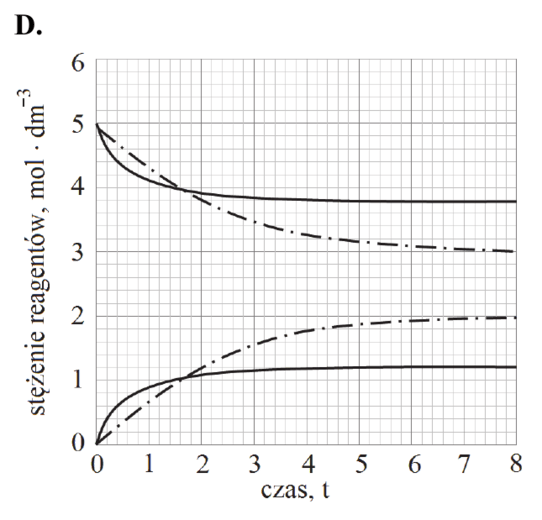
Poniżej zestawiono wykresy przedstawiające zależność stężenia PCl5 od czasu. Osie na wszystkich wykresach są wyskalowane tak samo.
Rozstrzygnij, na którym z poniższych wykresów (1.–4.) niebieska linia przedstawia zmianę stężenia molowego chlorku fosforu(V) PCl5 w trakcie reakcji prowadzonej w wyższej temperaturze. Odpowiedź uzasadnij – zapisz dwa różne argumenty.
Rozstrzygnięcie:
Argumenty: