Biomedica 2022, Poziom rozszerzony (Formuła 2015) - Zadanie 3. (3 pkt)
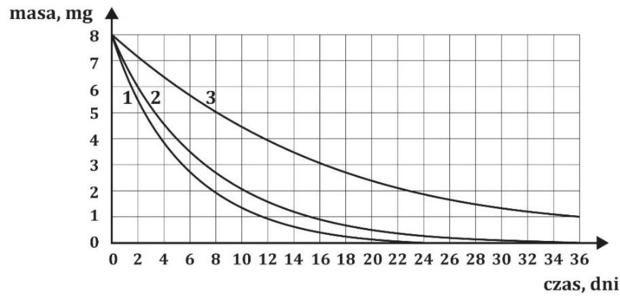
Poniższy wykres ilustruje zanik promieniotwórczych nuklidów (oznaczonych 1, 2, 3) w zależności od czasu.
3.1. (0-1)
Podaj, który z przedstawionych na wykresie nuklidów (1, 2, 3) jest najmniej stabilnym izotopem.
3.2. (0-1)
Oszacuj czas połowicznego rozpadu izotopu oznaczonego nr 2.
3.3. (0-1)
Oblicz, jaki procent pierwotnej masy nuklidu nr 3 pozostanie po upływie 60 dni. Do obliczeń czas półtrwania nuklidu nr 3 należy zaokrąglić do liczb całkowitych.