Test diagnostyczny (matura próbna) Grudzień 2024, Poziom rozszerzony (Formuła 2023) - Zadanie 15. (3 pkt)
W czterech zlewkach znajdowały się – w losowej kolejności – bezbarwne wodne roztwory różnych soli: węglanu sodu, azotanu(V) ołowiu(II), jodku potasu i siarczanu(VI) cynku. W każdej zlewce był roztwór innej soli. Roztwory tych soli oznaczono numerami I–IV. W celu identyfikacji zawartości każdej zlewki przeprowadzono dwuetapowe doświadczenie.
Etap 1. Roztwór I wprowadzono do trzech probówek, a następnie do każdej z nich dodano po około 2 cm3 roztworu II, III i IV. Analogicznie postąpiono z pozostałymi roztworami:
- do roztworu II dodano roztwory I, III i IV
- do roztworu III dodano roztwory I, II i IV
- do roztworu IV dodano roztwory I, II i III.
Wyniki doświadczenia przedstawiono w tabeli.
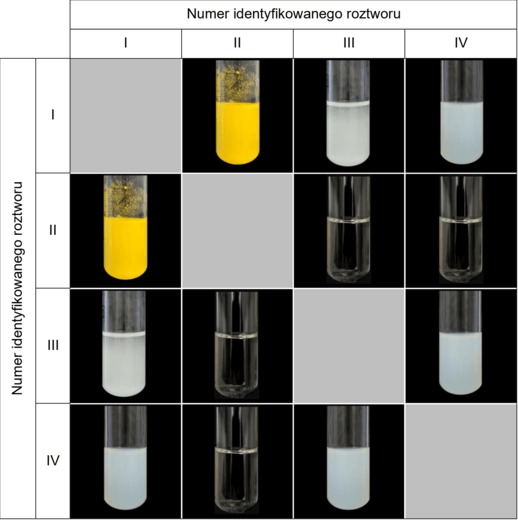
Etap 2. Niewielkie objętości roztworów I–IV przelano do czterech probówek i zbadano ich odczyn przy użyciu alkoholowego roztworu błękitu bromotymolowego. Poniżej przedstawiono wyniki przeprowadzonego doświadczenia.
15.1. (0–2)
Napisz w formie jonowej skróconej równania reakcji, które zaszły przy użyciu roztworu III w etapie 1. przeprowadzonego doświadczenia.
15.2. (0–1)
Napisz równanie reakcji decydującej o odczynie roztworu IV. Wpisz do schematu wzory odpowiednich drobin. Zastosuj definicję kwasu i zasady Brønsteda.














