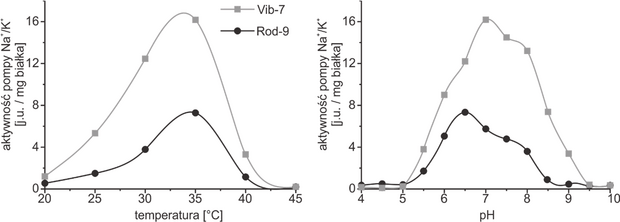
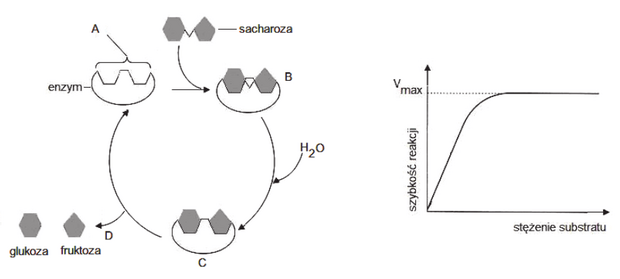
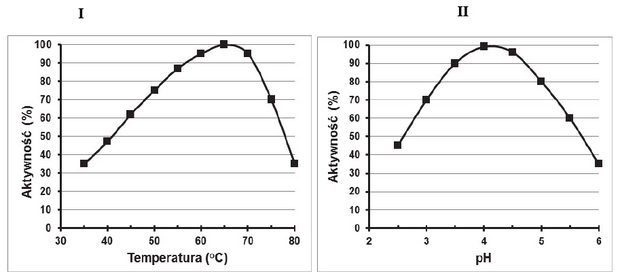
Matura Maj 2023, Poziom rozszerzony (Formuła 2015) - Zadanie 1. (4 pkt)
Kolejnymi etapami oddychania tlenowego są: glikoliza, reakcja pomostowa, cykl Krebsa oraz łańcuch oddechowy.
Reakcję pomostową – oksydacyjną dekarboksylację pirogronianu do acetylo-CoA –
katalizuje kompleks dehydrogenazy pirogronianowej, zawierający trzy enzymy: E1, E2 i E3.
Sumaryczna reakcja katalizowana przez ten kompleks w warunkach tlenowych jest
następująca:
pirogronian + CoA-SH + NAD+ → acetylo-CoA + CO2 + NADH + H+
Na schemacie przedstawiono współdziałanie trzech enzymów wchodzących w skład kompleksu dehydrogenazy pirogronianowej.
1.1. (0–1)
Uzupełnij tabelę – do każdego wymienionego typu reakcji zachodzącej podczas przekształcania pirogronianu do acetylo-CoA przyporządkuj odpowiednie oznaczenie enzymu (E1, E2 albo E3), który tę reakcję przeprowadza.
| Typ reakcji | Oznaczenie enzymu (E1 / E2 / E3) |
|---|---|
| transacetylacja | |
| dehydrogenacja | |
| dekarboksylacja |
1.2. (0–1)
W której części komórki eukariotycznej znajduje się aktywny kompleks dehydrogenazy pirogronianowej? Zaznacz właściwą odpowiedź spośród podanych.
- cytozol
- macierz mitochondrialna
- zewnętrzna błona mitochondrium
- wewnętrzna błona mitochondrium
- przestrzeń międzybłonowa w mitochondrium
1.3. (0–1)
Wykaż, że funkcjonowanie kompleksu dehydrogenazy pirogronianowej jest konieczne do połączenia szlaku glikolizy z cyklem Krebsa.
1.4. (0–1)
Wykaż, że zmniejszenie aktywności kompleksu dehydrogenazy pirogronianowej prowadzi do wzrostu stężenia mleczanu w komórce mięśnia szkieletowego.