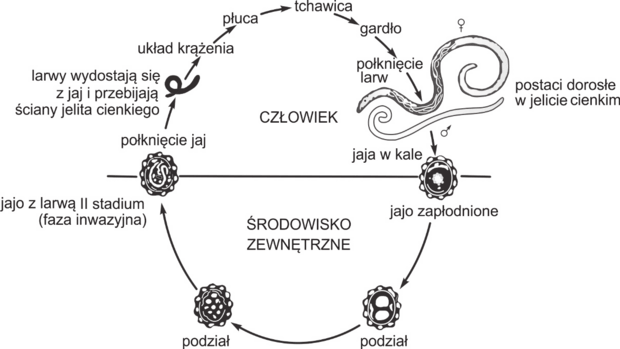
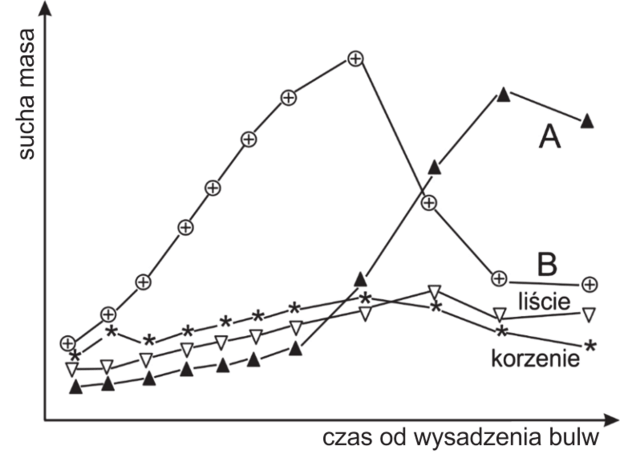
Matura Maj 2021, Poziom rozszerzony (Formuła 2015) - Zadanie 2. (4 pkt)
W komórkach eukariotycznych gradient protonowy jest wykorzystywany zarówno do syntezy ATP, jak i do transportu niektórych metabolitów przez wewnętrzną błonę mitochondrialną. Na poniższym schemacie przedstawiono proces transportu pirogronianu i kwasu ortofosforowego (Pi).
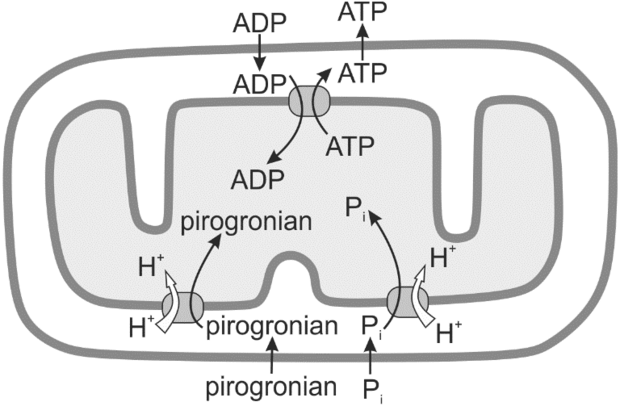
2.1. (0–2)
Uzupełnij poniższe zdania tak, aby w poprawny sposób opisywały powstawanie gradientu protonowego w mitochondriach. W każdym nawiasie podkreśl właściwe określenie.
Elektrony pochodzące ze zredukowanych podczas cyklu Krebsa dinukleotydów – NADH oraz FADH2 – są przenoszone na cząsteczkę (dwutlenku węgla / tlenu) poprzez łańcuch przenośników elektronów związanych z (wewnętrzną / zewnętrzną) błoną mitochondrialną. Energia uwolniona podczas przepływu elektronów przez łańcuch oddechowy jest wykorzystywana do transportu protonów, które przemieszczają się w kierunku ich (mniejszego / większego) stężenia do przestrzeni międzybłonowej mitochondrium, gdzie panuje (niższe / wyższe) pH niż w matriks mitochondrium.
2.2. (0–1)
Uzasadnij, że dla efektywnego zachodzenia procesów oddychania wewnątrzkomórkowego
konieczny jest ciągły transport kwasu ortofosforowego (Pi) oraz ADP do wnętrza
mitochondrium.
2.3. (0–1)
Uzupełnij tabelę – wpisz nazwy opisanych etapów oddychania komórkowego.
| Opis etapu oddychania komórkowego | Nazwa etapu | |
|---|---|---|
| 1. | Zachodzi w cytozolu komórki zwierzęcej, a jego produktem końcowym jest pirogronian. | |
| 2. | Zachodzi w matriks mitochondrium, a pirogronian jest jego substratem. |