Chemia - Matura Czerwiec 2024, Poziom rozszerzony (Formuła 2015)
Zadanie 1. (3 pkt)
Dwa pierwiastki E i X tworzą jony E+ i X– o takiej samej konfiguracji elektronowej 1s22s22p63s23p6 (stan podstawowy). W atomie jednego z trwałych izotopów pierwiastka E liczba nukleonów jest o 20 większa od liczby protonów.
1.1. (0–1)
Uzupełnij poniższy schemat. Wpisz w odpowiednie pola symbol pierwiastka E, jego liczbę atomową oraz liczbę masową opisanego izotopu.
1.2. (0–1)
Napisz fragment konfiguracji elektronowej atomu X w stanie podstawowym opisujący rozmieszczenie elektronów walencyjnych na orbitalach. Zastosuj graficzny (klatkowy) zapis konfiguracji elektronowej. W zapisie uwzględnij numer powłoki i symbole podpowłok.
1.3. (0–1)
Pierwiastek E przyjmuje w związkach chemicznych jeden stopień utlenienia, a pierwiastek X tworzy związki, w których występuje na różnych stopniach utlenienia.
Określ charakter chemiczny (kwasowy, zasadowy, amfoteryczny, obojętny) tlenku pierwiastka E. Napisz wzór sumaryczny tlenku pierwiastka X, w którym ten pierwiastek przyjmuje najwyższy stopień utlenienia.
Charakter chemiczny tlenku pierwiastka E:
Wzór sumaryczny tlenku pierwiastka X na najwyższym stopniu utlenienia:
Zadanie 2. (3 pkt)
Gal tworzy trihalogenki, np. chlorek galu(III). W fazie stałej chlorek galu(III) występuje głównie w postaci dimerów, a w fazie gazowej – jako mieszanina dimerów i monomerów. Monomer chlorku galu(III) jest płaską cząsteczką, w której wszystkie atomy chloru są równocenne. Model dimeru przedstawiono na rysunku.
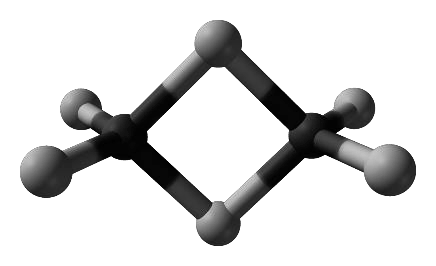
2.1. (0–1)
Narysuj wzór elektronowy monomeru chlorku galu(III). Zaznacz kreskami wiążące i wolne pary elektronowe.
Wzór monomeru chlorku galu(III):
2.2. (0–1)
Uzupełnij tabelę. Napisz, jaki typ hybrydyzacji (sp, sp2 albo sp3) przypisuje się orbitalom walencyjnym atomu galu w monomerze oraz w dimerze chlorku galu(III).
| Chlorek galu(III): | monomer | dimer |
|---|---|---|
| Typ hybrydyzacji |
2.3. (0–1)
Wyjaśnij, dlaczego monomery chlorku galu(III) mają zdolność łączenia się w dimery. Uwzględnij sposób powstawania wiązań, dzięki którym z monomeru chlorku galu(III) powstaje dimer.
Zadanie 3. (3 pkt)
Tytan jest lekkim metalem odpornym na korozję. W zależności od stopnia utlenienia tytanu chlorki tego pierwiastka odznaczają się różnymi właściwościami fizycznymi. Wartości temperatury topnienia i temperatury wrzenia dwóch związków tytanu z chlorem zestawiono w poniższej tabeli.
| Wzór związku tytanu z chlorem | Temperatura topnienia, °C | Temperatura wrzenia, °C |
|---|---|---|
| TiCl2 | 1035 | 1500 |
| TiCl4 | – 24 | 136 |
Reakcja tlenku tytanu(IV) – o wzorze TiO2 – z tetrachlorometanem w temperaturze 500 °C prowadzi do powstania chlorku tytanu(IV) oraz tlenku węgla(IV) (reakcja 1.). Z kolei chlorek tytanu(II) – jako jedyny produkt reakcji – można otrzymać w wyniku przepuszczania par chlorku tytanu(IV) w temperaturze 1040 °C nad metalicznym tytanem (reakcja 2.).
3.1. (0–1)
Uzupełnij poniższe zdania dotyczące tytanu i jego chlorków. Wybierz i zaznacz jedno określenie spośród podanych w każdym nawiasie..
Sieć krystaliczna metalicznego tytanu składa się z (atomów / kationów) otoczonych chmurą zdelokalizowanych elektronów. W sieci krystalicznej chlorku tytanu(II) obecne są (atomy / jony). Wraz z obniżeniem stopnia utlenienia tytanu w chlorkach (maleje / rośnie) jonowy charakter wiązania.
3.2. (0–2)
Napisz w formie cząsteczkowej równania opisanych reakcji otrzymywania TiCl4 (reakcja 1.) i TiCl2 (reakcja 2.). Rozstrzygnij, czy dana przemiana jest reakcją utleniania-redukcji. Zaznacz TAK albo NIE.
Równanie reakcji 1.:
Równanie reakcji 2.:
Zadanie 4. (1 pkt)
Badano szybkość reakcji opisanej równaniem
(CH3)3CCl (c) + H2O (c) → (CH3)3C(OH) (aq) + HCl (aq)
Dokończ zdanie. Wybierz odpowiedź A albo B i jej uzasadnienie 1., 2. albo 3.
Pomiar pH roztworu, w którym zachodzi opisana reakcja,
| A. | umożliwia wyznaczenie szybkości tej reakcji, | ponieważ w miarę jej postępu | 1. | pH roztworu pozostaje stałe. |
| 2. | pH roztworu maleje. | |||
| B. | nie umożliwia wyznaczenia szybkości tej reakcji, | |||
| 3. | pH roztworu rośnie. |
Zadanie 5. (1 pkt)
Poniżej przedstawiono równanie syntezy chlorowodoru.
H2 (g) + Cl2 (g) ⇄ 2HCl (g) ΔH° < 0
Tę reakcję prowadzono w zamkniętym reaktorze i po pewnym czasie w układzie reakcyjnym ustaliła się równowaga.
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.
| 1. | Podwyższenie temperatury (w warunkach izobarycznych) skutkuje wzrostem wydajności tworzenia chlorowodoru. | P | F |
| 2. | Zmiana ciśnienia (w warunkach izotermicznych) nie wpływa na wydajność tworzenia chlorowodoru. | P | F |
Zadanie 6. (1 pkt)
Reakcja tlenku węgla(IV) z wodorem przebiega zgodnie z równaniem:
CO2 (g) + H2 (g) ⇄ CO (g) + H2O (g)
W tabeli przedstawiono wartości stężeniowej stałej równowagi Kc tej reakcji w wybranych temperaturach.
| Temperatura, K | 400 | 600 | 800 | 1000 |
| Stała równowagi | 6,47 ∙ 10–4 | 3,54 ∙ 10–2 | 2,37 ∙ 10–1 | 6,97 ∙ 10–1 |
Rozstrzygnij, czy reakcja tlenku węgla(IV) z wodorem jest procesem endoenergetycznym. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 7. (2 pkt)
Reakcja tlenku węgla(IV) z wodorem przebiega zgodnie z równaniem:
CO2 (g) + H2 (g) ⇄ CO (g) + H2O (g)
W tabeli przedstawiono wartości stężeniowej stałej równowagi Kc tej reakcji w wybranych temperaturach.
| Temperatura, K | 400 | 600 | 800 | 1000 |
| Stała równowagi | 6,47 ∙ 10–4 | 3,54 ∙ 10–2 | 2,37 ∙ 10–1 | 6,97 ∙ 10–1 |
Do reaktora o stałej pojemności wprowadzono 10 moli tlenku węgla(IV) i 5 moli wodoru. Reaktor zamknięto i w temperaturze 800 K zainicjowano reakcję. Po pewnym czasie układ osiągnął stan równowagi.
Oblicz stosunek molowy tlenku węgla(IV) do wodoru w reaktorze po ustaleniu się stanu równowagi w temperaturze 800 K.
Zadanie 8. (1 pkt)
Nawozy stosowane do zasilania gleby w azot mogą powodować jej zakwaszanie i nie powinny być stosowane do nawożenia gleb kwaśnych.
Spośród wymienionych poniżej związków:
wybierz i zaznacz ten, który może spowodować dalsze zakwaszenie gleby kwaśnej. Napisz w formie jonowej równanie reakcji, której przebieg skutkuje zakwaszeniem gleby przez wybrany związek. Zastosuj definicję kwasu i zasady Brønsteda.
Zadanie 9. (2 pkt)
Zbadano właściwości dwóch wodorotlenków (I i II) wybranych spośród wymienionych poniżej.
W doświadczeniu użyto wodnego roztworu kwasu siarkowego(VI) oraz wodnego roztworu wodorotlenku sodu. Stwierdzono, że:
- wodorotlenek I roztworzył się zarówno w roztworze kwasu siarkowego(VI), jak i w roztworze wodorotlenku sodu. Powstały bezbarwne, klarowne roztwory
- wodorotlenek II roztworzył się zarówno w roztworze kwasu siarkowego(VI), jak i w roztworze wodorotlenku sodu. Powstały klarowne roztwory o barwie zielonej.
W reakcjach, w których powstają hydroksokompleksy, atom centralny w jonie kompleksowym ma liczbę koordynacyjną równą 4.
Wybierz i napisz wzór wodorotlenku I oraz napisz w formie jonowej równanie reakcji wodorotlenku II z wodorotlenkiem sodu.
Wzór wodorotlenku I:
Równanie reakcji wodorotlenku II z wodorotlenkiem sodu:
Zadanie 10. (1 pkt)
Azotki berylowców, o wzorze ogólnym Me3N2 (Me – atom berylowca), powstają w trakcie ogrzewania tych metali w atmosferze azotu. Są to związki o budowie jonowej składające się z kationów metali i anionów azotkowych N3–.
W wyniku spalania magnezu w powietrzu powstają dwa związki o stałym stanie skupienia: tlenek magnezu i azotek magnezu. Te reakcje można opisać równaniami:
2Mg + O2 → 2MgO
3Mg + N2 → Mg3N2
Azotek magnezu reaguje z wodą zgodnie z poniższym równaniem:
Mg3N2 + 6H2O → 3Mg(OH)2 + 2NH3
Uzupełnij tabelę. Uwzględnij stałą Avogadra i napisz, ile kationów magnezu i anionów azotkowych znajduje się w 1 molu azotku magnezu.
| Liczba kationów magnezu | Liczba anionów azotkowych |
|---|---|
Zadanie 11. (2 pkt)
Azotki berylowców, o wzorze ogólnym Me3N2 (Me – atom berylowca), powstają w trakcie ogrzewania tych metali w atmosferze azotu. Są to związki o budowie jonowej składające się z kationów metali i anionów azotkowych N3–.
W wyniku spalania magnezu w powietrzu powstają dwa związki o stałym stanie skupienia: tlenek magnezu i azotek magnezu. Te reakcje można opisać równaniami:
2Mg + O2 → 2MgO
3Mg + N2 → Mg3N2
Azotek magnezu reaguje z wodą zgodnie z poniższym równaniem:
Mg3N2 + 6H2O → 3Mg(OH)2 + 2NH3
Przeprowadzono następujące doświadczenie: próbkę magnezu spalono w powietrzu i otrzymano 0,15 g mieszaniny tlenku i azotku magnezu. W reakcji tej mieszaniny z wodą wydzielił się gaz o objętości równej 4,7 cm3 w przeliczeniu na warunki normalne.
Oblicz, jaki procent masy mieszaniny tlenku i azotku magnezu stanowi MgO. Przyjmij, że reakcja wydzielania gazu zaszła z wydajnością równą 100%.
Zadanie 12. (1 pkt)
Wprowadzenie CO2 do roztworu pozostającego w równowadze z osadem węglanów
powoduje ich przemianę w lepiej rozpuszczalne wodorowęglany.
Stężenie CO2 w roztworze zwiększa się wraz ze wzrostem ciśnienia tego gazu w mieszaninie
gazów (np. w powietrzu) nad roztworem. W tabeli przedstawiono stężenie jonów Ca2+
w roztworze pozostającym w równowadze z osadem węglanu wapnia w zależności od
ciśnienia CO2 w mieszaninie gazów nad roztworem (w temperaturze 𝑇).
| ciśnienie CO2, kPa | 0,0 | 0,032 | 1,0 |
| stężenie jonów Ca2+, mol · dm–3 | 2,53 ∙ 10–5 | 8,68 ∙ 10–4 | 2,73 ∙ 10–3 |
Uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Wartość pH wody, w której rozpuszcza się CO2, (rośnie / maleje). Przy wzroście ciśnienia tlenku węgla(IV) w mieszaninie gazów nad roztworem, w układzie mającym temperaturę 𝑇, od wartości 0,0 kPa do wartości 1,0 kPa następuje ok. 100-krotny (wzrost / spadek) stężenia jonów Ca2+ w wodzie.
Zadanie 13. (2 pkt)
Wprowadzenie CO2 do roztworu pozostającego w równowadze z osadem węglanów
powoduje ich przemianę w lepiej rozpuszczalne wodorowęglany.
Stężenie CO2 w roztworze zwiększa się wraz ze wzrostem ciśnienia tego gazu w mieszaninie
gazów (np. w powietrzu) nad roztworem. W tabeli przedstawiono stężenie jonów Ca2+
w roztworze pozostającym w równowadze z osadem węglanu wapnia w zależności od
ciśnienia CO2 w mieszaninie gazów nad roztworem (w temperaturze 𝑇).
| ciśnienie CO2, kPa | 0,0 | 0,032 | 1,0 |
| stężenie jonów Ca2+, mol · dm–3 | 2,53 ∙ 10–5 | 8,68 ∙ 10–4 | 2,73 ∙ 10–3 |
Węglan ołowiu(II) jest białym ciałem stałym. Przeprowadzono doświadczenie, w którym do dwóch probówek dodano niewielką ilość węglanu ołowiu(II) oraz wodę i otrzymano zawiesinę.
13.1. (0–1)
Przez zawiesinę znajdującą się w pierwszej probówce przepuszczono CO2 i zaobserwowano zanik osadu.
Napisz w formie jonowej równanie reakcji zachodzącej w tej probówce. .................................................................................................................................................
13.2. (0–1)
Do drugiej probówki dodano niewielką ilość świeżo przygotowanego wodnego roztworu KI i nie zaobserwowano żadnych zmian. Następnie przez zawiesinę znajdującą się w tej probówce przepuszczono CO2. W probówce powstał osad o żółtej barwie.
Napisz w formie jonowej skróconej równanie reakcji, która była przyczyną
obserwowanych zmian.
Zadanie 14. (2 pkt)
W temperaturze 𝑇 do zlewki zawierającej 50,0 g wodnego roztworu jodku potasu o stężeniu równym 2,00% dodano 100 cm3 wodnego roztworu azotanu(V) ołowiu(II) o stężeniu równym 0,0300 mol ∙ dm−3. Przebiegła reakcja wytrącania PbI2. Otrzymany osad po odsączeniu i wysuszeniu ważył 1,24 g.
Oblicz wydajność reakcji otrzymywania jodku ołowiu(II) w doświadczeniu w temperaturze T.
Zadanie 15. (2 pkt)
Do zlewki zawierającej wodę destylowaną dodano stały wodorotlenek magnezu. Po pewnym czasie w zlewce ustalił się stan równowagi między osadem i roztworem, czyli powstał nasycony roztwór tej substancji. Osad oddzielono od roztworu, a otrzymany przesącz umieszczono w dwóch probówkach. Do jednej probówki wprowadzono stały wodorotlenek potasu, a do drugiej – rozcieńczony kwas solny, co zilustrowano na poniższym rysunku. Podczas doświadczenia utrzymywano stałą temperaturę T.
Rozstrzygnij, czy dodanie stałego wodorotlenku potasu do jednej próbki przesączu i kwasu solnego do drugiej próbki poskutkowało zmianą stężenia jonów Mg2+ w roztworze (w temperaturze T). Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie. Odpowiedzi uzasadnij.
Dodanie stałego wodorotlenku potasu do próbki przesączu (poskutkowało zmniejszeniem /
poskutkowało zwiększeniem / nie wpłynęło na wartość) stężenia jonów Mg2+ w roztworze.
Uzasadnienie:
Dodanie kwasu solnego do próbki przesączu (poskutkowało zmniejszeniem /
poskutkowało zwiększeniem / nie wpłynęło na wartość) stężenia jonów Mg2+ w roztworze.
Uzasadnienie:
Zadanie 16. (2 pkt)
Po wprowadzeniu tlenku chloru(IV) do wodnego roztworu wodorotlenku sodu zachodzi reakcja opisana schematem:
ClO2 + OH– ⟶ ClO–2 + ClO–3 + H2O
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania reakcji redukcji i utleniania zachodzących podczas opisanego procesu. Uwzględnij środowisko reakcji.
Równanie reakcji redukcji:
Równanie reakcji utleniania:
Zadanie 17. (3 pkt)
Metale X i E tworzą jony proste – odpowiednio – X2+ i E2+. Blaszki o znanych masach, wykonane z metalu X i z metalu E, zanurzono w roztworach soli trzech różnych metali, zgodnie ze schematem:
Objawy świadczące o zajściu reakcji chemicznych zaobserwowano w probówkach I i II. Po zakończeniu doświadczenia blaszki osuszono i zważono. Stwierdzono, że masa blaszki wykonanej z metalu X wzrosła, a masa blaszki wykonanej z metalu E zmalała.
17.1. (0–1)
Zastosuj symbol X i napisz w formie jonowej skróconej równanie reakcji zachodzącej w probówce I.
17.2. (0–1)
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.
| 1. | Metal X jest silniejszym reduktorem niż srebro. | P | F |
| 2. | Jony żelaza(II) są silniejszym utleniaczem niż jony metalu X. | P | F |
17.3. (0–1)
Poniżej podano nazwy czterech metali.
Wybierz i napisz nazwę metalu X i nazwę metalu E, które mogły być użyte w doświadczeniu.
Metal X:
Metal E:
Zadanie 18. (1 pkt)
W tabeli podano wartości standardowej entalpii uwodornienia: cykloheksenu, cykloheksa-1,3-dienu i benzenu:
Na podstawie danych zamieszczonych w tabeli uzupełnij poniższe zdania. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Gdyby wiązania 𝜋 w cząsteczce benzenu nie były zdelokalizowane, entalpia uwodornienia tego związku miałaby znacznie (niższą / wyższą) wartość niż −207,0 kJ ∙ mol−1. Delokalizacja wiązań 𝜋 skutkuje (zwiększeniem / zmniejszeniem) trwałości cząsteczki benzenu.
Zadanie 19. (1 pkt)
Propan-1-ol oraz wyższe alkohole pierwszorzędowe można otrzymać w procesie hydroformylowania alkenów terminalnych. Reakcja przebiega w warunkach podwyższonego ciśnienia i temperatury, w obecności katalizatorów (Co lub Ru) według schematu:
(alken terminalny) R–CH=CH2 + CO + 2H2 katalizator R–CH2–CH2–CH2OH
oraz I. Ojima, C.Y. Tsai, M. Tzamarioudaki, D. Bonafoux, The Hydroformylation Reaction, „Org. React.” 2000, nr 56, s. 1.
Napisz równanie reakcji otrzymywania alkoholu ze styrenu (fenyloetenu) opisaną metodą. Zastosuj wzory półstrukturalne (grupowe) lub uproszczone związków organicznych.
Zadanie 20. (2 pkt)
W zlewkach I, II i III umieszczono – w przypadkowej kolejności – wodne roztwory kwasów: mlekowego (2-hydroksypropanowego), migdałowego (2-fenylo-2-hydroksyetanowego) i galusowego (3,4,5-trihydroksybenzenokarboksylowego). Wzory kwasów przedstawiono poniżej.
W celu zidentyfikowania substancji przeprowadzono dwie próby.
W pierwszej próbie do trzech probówek z wodnym roztworem chlorku żelaza(III)
wprowadzono po kilka kropel roztworów badanych substancji ze zlewek I, II i III. Do każdej
probówki z chlorkiem żelaza(III) dodano roztwór jednego kwasu.
W drugiej próbie w trzech probówkach umieszczono po jednej z identyfikowanych substancji, oznaczając je zgodnie z oznaczeniem zlewki z której zostały pobrane. Następnie do probówek wprowadzono stężony kwas azotowy(V) z dodatkiem stężonego kwasu siarkowego(VI) i probówki ogrzano.
20.1. (0–1)
Wyniki przeprowadzonych prób przedstawiono w poniższej tabeli.
Uzupełnij tabelę. Wpisz nazwy kwasów, które były obecne w zlewkach I, II i III.
| Probówka I | Probówka II | Probówka III | |
|---|---|---|---|
| FeCl3 (aq) | żółty roztwór | niebieskoczarny roztwór | żółty roztwór |
| HNO3 (stężony) + H2SO4 | żółty roztwór | żółty roztwór | bezbarwny roztwór |
| Nazwa kwasu |
20.2. (0–1)
Podczas drugiej próby w dwóch probówkach zaobserwowano zmiany świadczące o przebiegu reakcji chemicznej.
Uzupełnij poniższe zdanie. Wybierz i zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Przemiany, które zaszły w drugiej próbie, są reakcjami (addycji / eliminacji / substytucji), przebiegającymi według mechanizmu (elektrofilowego / nukleofilowego / rodnikowego).
Zadanie 21. (2 pkt)
Poniżej przedstawiono wzory dwóch kwasów dikarboksylowych występujących w przyrodzie.
Przygotowano wodne roztwory soli sodowych kwasów: winowego i bursztynowego.
Uzupełnij schemat doświadczenia, które umożliwi rozróżnienie tych roztworów. Napisz nazwę odczynnika. Opisz obserwacje, które umożliwią identyfikację zawartości każdej probówki.
Lista odczynników:
- rozcieńczony kwas solny z oranżem metylowym
- wodny roztwór wodorotlenku sodu z fenoloftaleiną
- zalkalizowana świeżo strącona zawiesina wodorotlenku miedzi(II)
- mieszanina stężonych kwasów: azotowego(V) i siarkowego(VI).
Obserwacje:
Probówka z winianem disodu:
Probówka z bursztynianem disodu:
Zadanie 22. (1 pkt)
Poniżej przedstawiono wzory dwóch kwasów dikarboksylowych występujących w przyrodzie.
Napisz równanie reakcji kwasu winowego z alkoholem metylowym w obecności kwasu siarkowego(VI), w której powstaje produkt zawierający w cząsteczce sześć atomów węgla. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Zadanie 23. (1 pkt)
Kwas winowy jest stałą, krystaliczną substancją, dobrze rozpuszczalną w wodzie. Wodorowinian potasu KHC4H4O6, zwany kamieniem winnym, jest solą trudno rozpuszczalną w wodzie. Roztwarza się w wodnym roztworze wodorotlenku potasu.
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.
| 1. | Po zmieszaniu jednakowych objętości wodnego roztworu wodorotlenku potasu i wodnego roztworu kwasu winowego o takich samych stężeniach molowych powstaje osad. | P | F |
| 2. | Po zmieszaniu jednakowych objętości wodnego roztworu winianu potasu i wodnego roztworu kwasu winowego o takich samych stężeniach molowych powstaje osad. | P | F |
Zadanie 24. (1 pkt)
Kwas winowy jest stałą, krystaliczną substancją, dobrze rozpuszczalną w wodzie. Wodorowinian potasu KHC4H4O6, zwany kamieniem winnym, jest solą trudno rozpuszczalną w wodzie. Roztwarza się w wodnym roztworze wodorotlenku potasu.
Napisz w formie jonowej równanie reakcji, która zachodzi podczas roztwarzania wodorowinianu potasu w wodnym roztworze wodorotlenku potasu. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Zadanie 25. (2 pkt)
Poniżej przedstawiono wzór pewnego polimeru:
Napisz nazwę systematyczną monomeru o budowie łańcuchowej, z którego można otrzymać polimer o podanym wyżej wzorze. Rozstrzygnij, czy ten polimer powstał w reakcji polikondensacji. Uzasadnij swoją odpowiedź.
Nazwa systematyczna monomeru:
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 26. (2 pkt)
Próbkę związku X o masie 3,01 g poddano analizie spaleniowej i otrzymano 3,92 dm3 CO2 (w przeliczeniu na warunki normalne) oraz 3,15 g wody. O związku X wiadomo, że:
- może utworzyć dwie monochloropochodne
- nie odbarwia wody bromowej i nie reaguje z odczynnikiem Tollensa
- jego cząsteczki mają nierozgałęziony łańcuch węglowy.
Ustal wzór empiryczny, który jest jednocześnie wzorem rzeczywistym, związku X. Napisz jego wzór półstrukturalny (grupowy).
Wzór związku X:
Zadanie 27. (2 pkt)
Poniżej przedstawiono wzór cząsteczki pewnego związku:
27.1. (0–1)
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.
| 1. | Związek o przedstawionym wzorze można zaliczyć do grupy tłuszczów. | P | F |
| 2. | W wyniku hydrolizy zasadowej związku o przedstawionym wzorze powstaje, oprócz glicerolu, mieszanina kwasów tłuszczowych. | P | F |
27.2. (0–1)
Rozstrzygnij, czy cząsteczki tego związku są chiralne. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 28. (4 pkt)
Poniżej przedstawiono wzór pirydoksalu – jednego ze składników witaminy B6.
Atom azotu ma wolną parę elektronową, dlatego pirydoksal – podobnie jak inne aminy – reaguje z kwasami.
28.1. (0–2)
Uzupełnij tabelę. Wpisz formalny stopień utlenienia oraz typ hybrydyzacji (sp, sp2, sp3) orbitali walencyjnych atomu węgla oznaczonego literą a oraz atomu węgla oznaczonego literą b we wzorze pirydoksalu.
| Stopień utlenienia | Hybrydyzacja | |
|---|---|---|
| Atom węgla a | ||
| Atom węgla b |
28.2. (0–2)
Uzupełnij poniższe schematy. Wpisz wzory organicznych produktów przemian, tak aby powstały zapisane w formie jonowej skróconej równania reakcji pirydoksalu:
- z wodorotlenkiem sodu (reakcja 1.)
- z kwasem solnym (reakcja 2.).
Zastosuj wzory półstrukturalne (grupowe) lub uproszczone związków organicznych.
Równanie reakcji 1.:
Równanie reakcji 2.:
Zadanie 29. (2 pkt)
Nitrobenzen i anilina (benzenoamina) są bezbarwnymi cieczami, które na powietrzu i pod
wpływem światła przyjmują żółte zabarwienie.
W pierwszym etapie jedną z opisanych cieczy wprowadzono do zlewki z wodą, wymieszano
i pozostawiono na pewien czas. Zaobserwowano, że w naczyniu znajdowały się krople żółtej
cieczy, a uniwersalny papierek wskaźnikowy zanurzony w badanym roztworze przyjął
zielononiebieskie zabarwienie. W drugim etapie do mieszaniny dodano roztwór substancji X
i otrzymano klarowny roztwór.
Rozstrzygnij, który związek (nitrobenzen albo anilina) został wprowadzony do wody w opisanym doświadczeniu. Uzasadnij swoją odpowiedź.
Rozstrzygnięcie:
Uzasadnienie:
Spośród wymienionych niżej substancji wybierz tę, która mogła być użyta w drugim etapie doświadczenia, i zaznacz jej wzór. Wyjaśnij przyczynę zaobserwowanych zmian.
W drugim etapie doświadczenia można było użyć:
Wyjaśnienie:
Zadanie 30. (2 pkt)
Nitrobenzen i anilina (benzenoamina) są bezbarwnymi cieczami, które na powietrzu i pod
wpływem światła przyjmują żółte zabarwienie.
W pierwszym etapie jedną z opisanych cieczy wprowadzono do zlewki z wodą, wymieszano
i pozostawiono na pewien czas. Zaobserwowano, że w naczyniu znajdowały się krople żółtej
cieczy, a uniwersalny papierek wskaźnikowy zanurzony w badanym roztworze przyjął
zielononiebieskie zabarwienie. W drugim etapie do mieszaniny dodano roztwór substancji X
i otrzymano klarowny roztwór.
W temperaturze 25 °C w 100 g wody rozpuszcza się 3,5 g aniliny.
Oblicz pH wodnego roztworu aniliny nasyconego w temperaturze 25 °C. Przyjmij, że masa molowa tego związku jest równa 93 g ∙ mol−1, a gęstość otrzymanego roztworu jest równa gęstości wody.
Zadanie 31. (1 pkt)
Lecytyny są naturalnymi związkami o dużym znaczeniu biologicznym. Znalazły one zastosowanie m.in. w przemyśle spożywczym jako emulgatory, czyli substancje stabilizujące emulsję. Ogólną strukturę lecytyny przedstawia wzór:
Symbolami –R1 i –R2 oznaczono grupy węglowodorowe. Najczęściej występujące łańcuchy węglowodorowe w cząsteczkach lecytyny wymieniono w poniższej tabeli.
| –R1 | –R2 |
|---|---|
| –C15H31 –C17H35 –C17H33 |
–C17H33 –C17H31 –C17H29 |
Cząsteczka lecytyny zawsze zawiera co najmniej jeden nienasycony łańcuch węglowodorowy.
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.
| 1. | Istnieją cząsteczki lecytyny, które są achiralne. | P | F |
| 2. | Lecytyna jest substancją powierzchniowo czynną, ponieważ jej cząsteczka zawiera grupy polarne i łańcuchy niepolarne. | P | F |
Zadanie 32. (3 pkt)
Lecytyny są naturalnymi związkami o dużym znaczeniu biologicznym. Znalazły one zastosowanie m.in. w przemyśle spożywczym jako emulgatory, czyli substancje stabilizujące emulsję. Ogólną strukturę lecytyny przedstawia wzór:
Symbolami –R1 i –R2 oznaczono grupy węglowodorowe. Najczęściej występujące łańcuchy węglowodorowe w cząsteczkach lecytyny wymieniono w poniższej tabeli.
| –R1 | –R2 |
|---|---|
| –C15H31 –C17H35 –C17H33 |
–C17H33 –C17H31 –C17H29 |
Cząsteczka lecytyny zawsze zawiera co najmniej jeden nienasycony łańcuch węglowodorowy.
Próbkę lecytyny ogrzewano z wodnym roztworem wodorotlenku sodu. Zaszła reakcja chemiczna, zgodnie ze schematem:
32.1. (0–1)
Uzupełnij zdanie. Określ stosunek liczby moli wodorotlenku sodu do liczby moli lecytyny w opisanej reakcji.
Stosunek liczby moli wodorotlenku sodu do liczby moli lecytyny jest równy
:
32.2. (0–2)
W celu potwierdzenia obecności wybranych produktów reakcji mieszaninę poreakcyjną podzielono na trzy części i umieszczono w ponumerowanych probówkach. Do probówki 1. dodano wodę bromową, do 2. – zalkalizowaną świeżo strąconą zawiesinę wodorotlenku miedzi(II), natomiast do probówki 3. dodano kilka kropel wodnego roztworu chlorku wapnia.
Uzupełnij tabelę. Wpisz w odpowiednie miejsca:
- obserwowane efekty reakcji
- wzory produktów (cząsteczki lub jednego wybranego jonu), których obecność była przyczyną obserwowanych efektów (w miejsce grup –R1 albo –R2 wpisz wzór odpowiedniej grupy węglowodorowej).
| Numer probówki | Obserwowany efekt reakcji | Wzór wykrytej cząsteczki lub jonu |
|---|---|---|
| 1 | odbarwienie roztworu | |
| 2 | ||
| 3 | PO3−4 LUB C17H35COO− |
Zadanie 33. (1 pkt)
Poniżej przedstawiono wzór pewnego tripeptydu.
Napisz nazwę lub trzyliterowy kod aminokwasu C-końcowego, czyli tego którego reszta w cząsteczce tego tripeptydu zawiera wolną grupę karboksylową połączoną z atomem węgla α aminokwasu.
