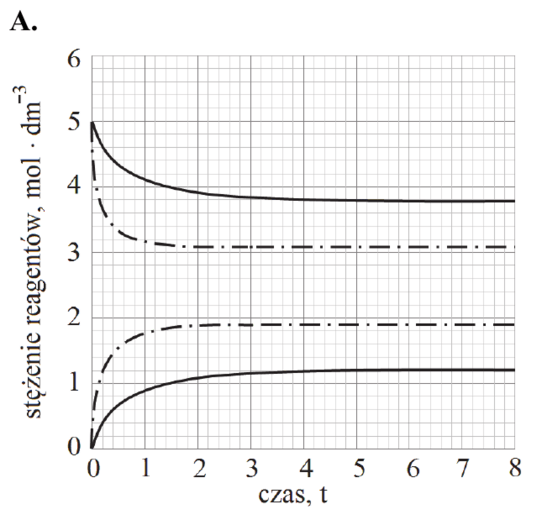
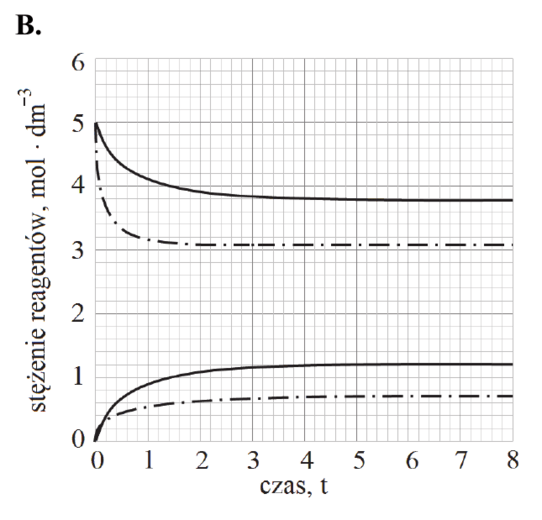
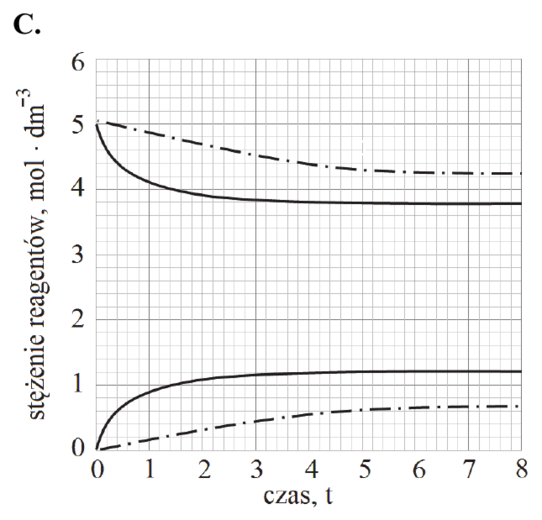
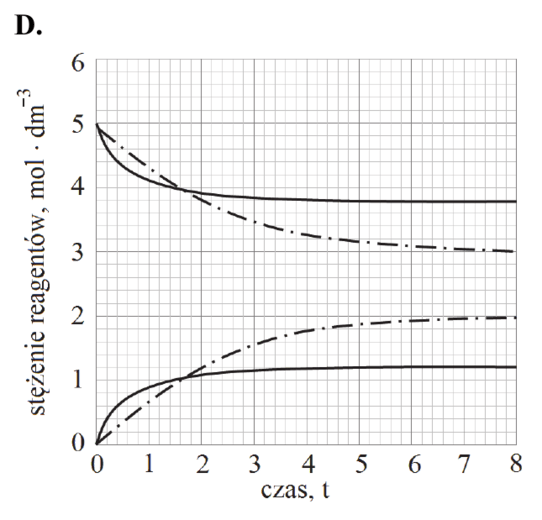
Matura Maj 2018, Poziom podstawowy (Formuła 2007) - Zadanie 16. (1 pkt)
Przeprowadzono doświadczenie zgodnie z poniższym rysunkiem.
Podczas doświadczenia w kolbie przebiegła reakcja chemiczna zilustrowana równaniem
Mg + 2HCl → MgCl2 + H2
Oceń, czy zmieni się (wzrośnie albo zmaleje), czy też nie ulegnie zmianie szybkość opisanej reakcji magnezu z kwasem solnym, jeżeli
- zamiast użytych w doświadczeniu wiórków magnezu użyje się pyłu magnezowego
- zamiast użytego do reakcji kwasu solnego o stężeniu cm użyje się kwasu solnego o stężeniu 12 cm.