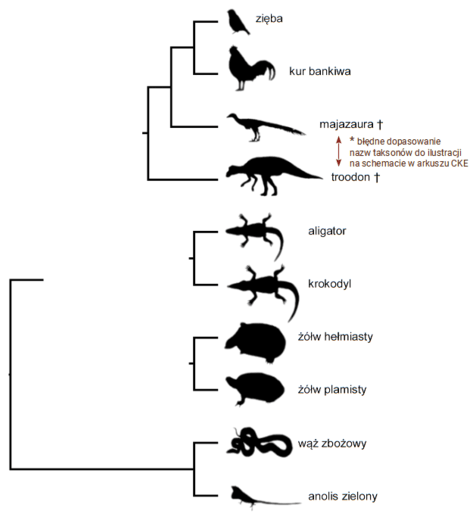
Test diagnostyczny CKE Grudzień 2022, Poziom rozszerzony (Formuła 2023) - Zadanie 11. (4 pkt)
W poniższej tabeli zamieszczono dane dotyczące rozpuszczalności substancji X w wodzie, a na wykresie przedstawiono krzywą zależności rozpuszczalności substancji Y w wodzie.
| Temperatura, °C | Rozpuszczalność substancji X, g na 100 g wody |
|---|---|
| 0 | 89 |
| 20 | 53 |
| 40 | 33 |
| 60 | 23 |
| 80 | 16 |
11.1. (0–2)
Narysuj na wykresie krzywą rozpuszczalności substancji X i wyznacz wartość temperatury, w której substancje X i Y mają taką samą rozpuszczalność. Oblicz stężenie procentowe nasyconego roztworu substancji X lub Y w tej temperaturze.
Substancje X i Y mają taką samą rozpuszczalność w temperaturze ℃.
Stężenie % nasyconego roztworu:
11.2. (0–2)
Spośród wymienionych niżej substancji wybierz tę, która była oznaczona symbolem X, oraz tę, która była oznaczona symbolem Y. Napisz ich wzory i uzasadnij swój wybór.
Wzór substancji X:
Uzasadnienie:
Wzór substancji Y:
Uzasadnienie: