Zadania dodatkowe matury dwujęzycznej (tłumaczenie BiologHelp) Maj 2024, Poziom rozszerzony (Formuła 2023) - Zadanie 8. (1 pkt)
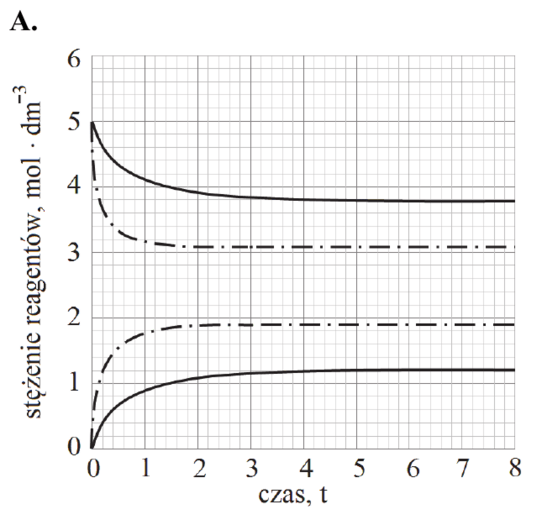
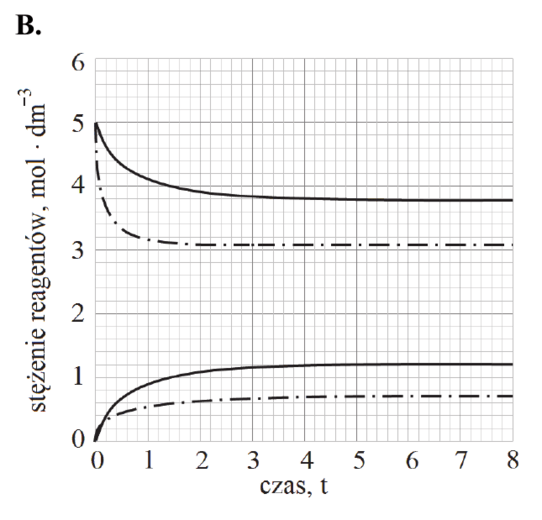
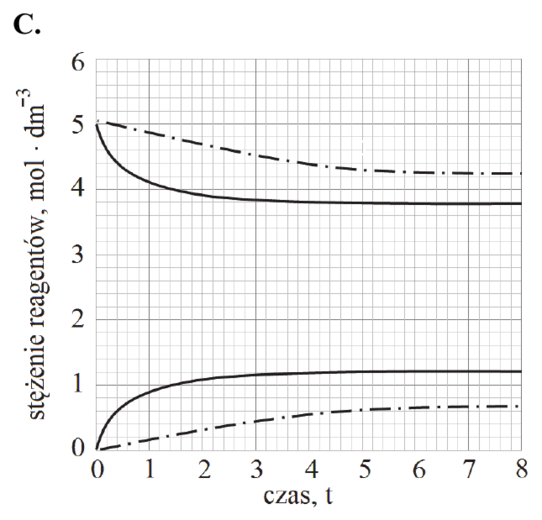
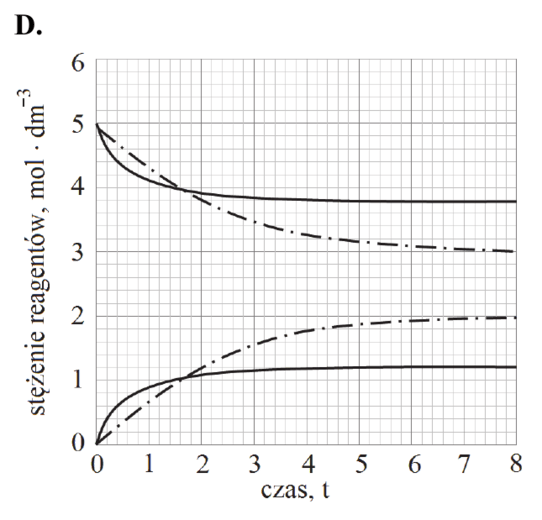
Reakcja rozkładu jodowodoru przebiega zgodnie z poniższym równaniem:
2HI (g) ⇄ H2 (g) + I2 (g)
W tabeli podano wartości stałej równowagi tej reakcji w wybranych temperaturach (pod ciśnieniem p = 1013 hPa).
| Temperatura, K | 400 | 600 | 800 |
| Stała równowagi | 4,07 ∙ 10‒3 | 1,24 ∙ 10‒2 | 2,31 ∙ 10‒2 |
Oceń, czy poniższe stwierdzenia są prawdziwe. Zaznacz P, jeśli stwierdzenie jest prawdziwe, albo F – jeśli jest fałszywe.
| 1. | Wzrost temperatury (przy p = const) skutkuje spadkiem wydajności reakcji rozkładu jodowodoru. | P | F |
| 2. | Wzrost ciśnienia (przy T = const) nie skutkuje zmianą wydajności reakcji rozkładu jodowodoru. | P | F |