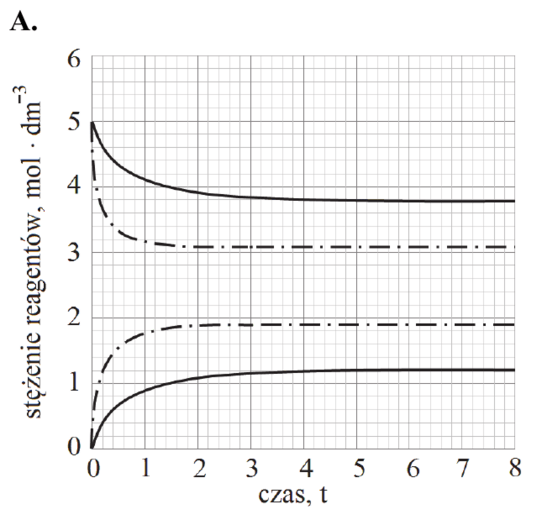
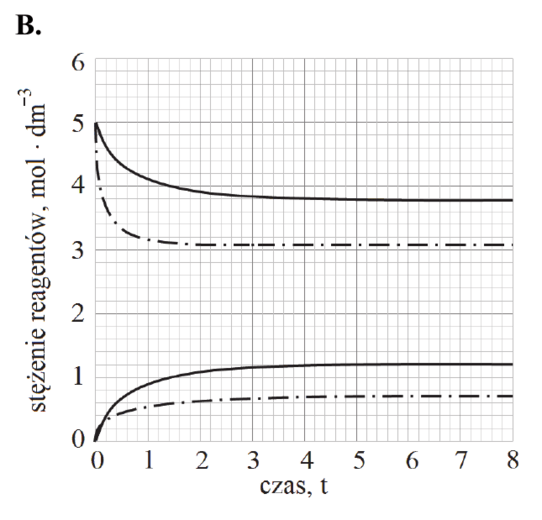
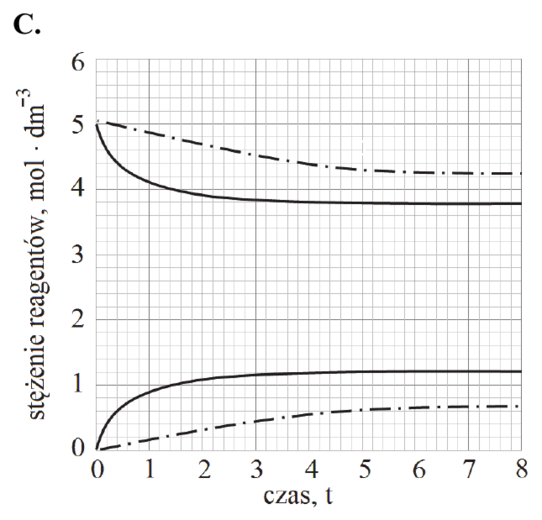
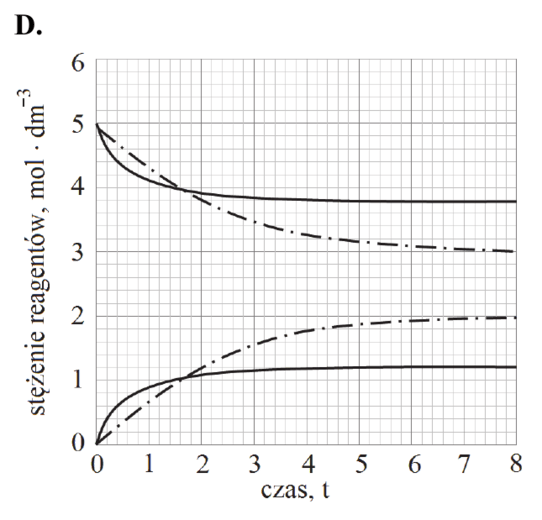
Matura Czerwiec 2018, Poziom rozszerzony (Formuła 2015) - Zadanie 15. (1 pkt)
Do probówki ze stałym etanianem (octanem) sodu dodano kwas siarkowy(VI) i zawartość naczynia ogrzano. U wylotu próbówki wyczuwalny był charakterystyczny ostry zapach.
Napisz, czy użycie do przeprowadzenia opisanego doświadczenia kwasu ortofosforowego(V) zamiast kwasu siarkowego(VI) pozwoli na zaobserwowanie podobnych efektów.