Test diagnostyczny CKE Grudzień 2022, Poziom rozszerzony (Formuła 2023) - Zadanie 14. (2 pkt)
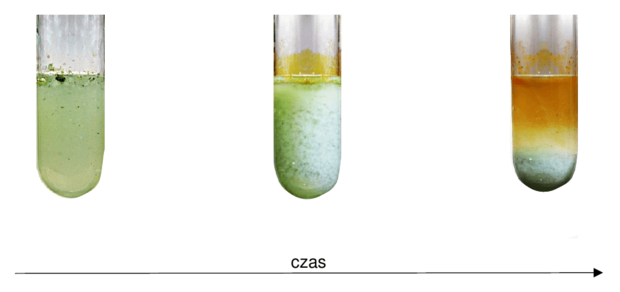
W trzech probówkach oznaczonych numerami 1, 2, 3, znajdowała się woda z dodatkiem oranżu metylowego. Do każdej z tych probówek wprowadzono małą porcję jednego z tlenków wybranych z poniższego zbioru:
Zawartość każdej z probówek wymieszano i pozostawiono na pewien czas.

14.1. (0–1)
Uzupełnij tabelę. Wpisz wzory tlenków wprowadzonych do probówek 1 i 2.
| Nr probówki | Wzór tlenku |
|---|---|
| 1 | |
| 2 |
14.2. (0–1)
Napisz w formie cząsteczkowej równanie reakcji, której produkt spowodował zmianę barwy oranżu metylowego w probówce 3.