Matura Czerwiec 2024, Poziom rozszerzony (Formuła 2023) - Zadanie 32. (3 pkt)
Lecytyny są naturalnymi związkami o dużym znaczeniu biologicznym. Znalazły one zastosowanie m.in. w przemyśle spożywczym jako emulgatory, czyli substancje stabilizujące emulsję. Ogólną strukturę lecytyny przedstawia wzór:
Symbolami –R1 i –R2 oznaczono grupy węglowodorowe. Najczęściej występujące łańcuchy węglowodorowe w cząsteczkach lecytyny wymieniono w poniższej tabeli.
| –R1 | –R2 |
|---|---|
| –C15H31 –C17H35 –C17H33 |
–C17H33 –C17H31 –C17H29 |
Cząsteczka lecytyny zawsze zawiera co najmniej jeden nienasycony łańcuch węglowodorowy.
Próbkę lecytyny ogrzewano z wodnym roztworem wodorotlenku sodu. Zaszła reakcja chemiczna, zgodnie ze schematem:
32.1. (0–1)
Uzupełnij zdanie. Określ stosunek liczby moli wodorotlenku sodu do liczby moli lecytyny w opisanej reakcji.
Stosunek liczby moli wodorotlenku sodu do liczby moli lecytyny jest równy
:
32.2. (0–2)
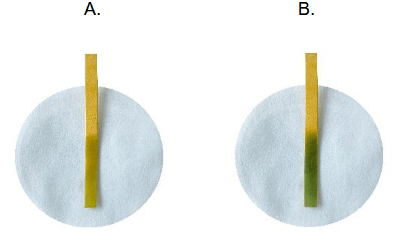
W celu potwierdzenia obecności wybranych produktów reakcji mieszaninę poreakcyjną podzielono na trzy części i umieszczono w ponumerowanych probówkach. Do probówki 1. dodano wodę bromową, do 2. – zalkalizowaną świeżo strąconą zawiesinę wodorotlenku miedzi(II), natomiast do probówki 3. dodano kilka kropel wodnego roztworu chlorku wapnia.
Uzupełnij tabelę. Wpisz w odpowiednie miejsca:
- obserwowane efekty reakcji
- wzory produktów (cząsteczki lub jednego wybranego jonu), których obecność była przyczyną obserwowanych efektów (w miejsce grup –R1 albo –R2 wpisz wzór odpowiedniej grupy węglowodorowej).
| Numer probówki | Obserwowany efekt reakcji | Wzór wykrytej cząsteczki lub jonu |
|---|---|---|
| 1 | odbarwienie roztworu | |
| 2 | ||
| 3 | PO3−4 LUB C17H35COO− |