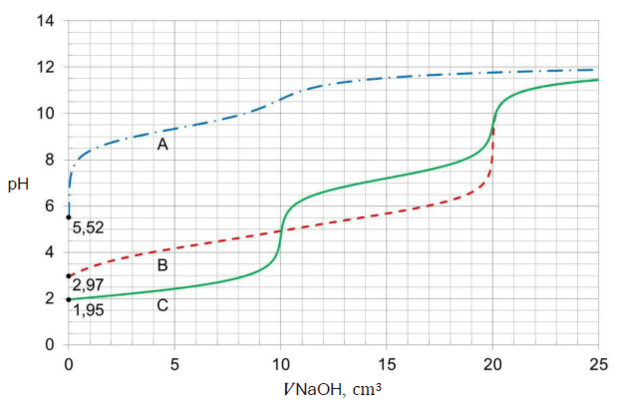
Zadania dodatkowe matury dwujęzycznej (tłumaczenie BiologHelp) Maj 2023, Poziom rozszerzony (Formuła 2023) - Zadanie 1. (2 pkt)
Konfiguracja elektronowa powłoki walencyjnej atomu pierwiastka chemicznego E w stanie podstawowym to 4s24p3.
1.1. (0–1)
Uzupełnij poniższą tabelę. Wpisz symbol chemiczny, numer grupy i numer okresu pierwiastka E.
| Symbol pierwiastka | Numer grupy | Numer okresu |
|---|---|---|
1.2. (0–1)
Napisz konfigurację elektronową jonu E3+ w stanie podstawowym. Użyj skróconej konfiguracji elektronowej z symbolem gazu szlachetnego.