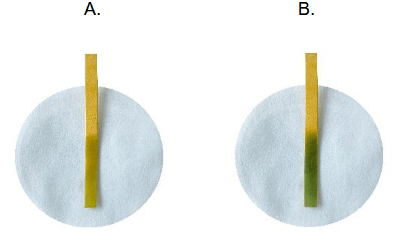
Zadania dodatkowe matury dwujęzycznej (tłumaczenie BiologHelp) Maj 2024, Poziom rozszerzony (Formuła 2023) - Zadanie 11. (1 pkt)
Do wodnego roztworu wodorowęglanu sodu dodano kwas solny. Zaobserwowano wydzielanie bezbarwnego gazu.
Napisz w formie jonowej skróconej równanie reakcji, w wyniku której wydzielił się bezbarwny gaz i określ, jaką funkcję – kwasu czy zasady Brønsteda – pełni w tej reakcji jon wodorowęglanowy.
Równanie reakcji:
Funkcja jonu wodorowęglanowego: