Matura Maj 2021, Poziom rozszerzony (Formuła 2015) - Zadanie 36. (2 pkt)
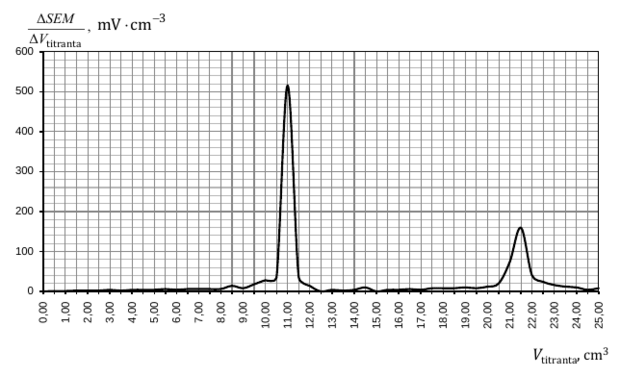
Do czterech probówek zawierających niebieską zalkalizowaną zawiesinę świeżo strąconego wodorotlenku miedzi(II) wprowadzono bezbarwne wodne roztwory czterech różnych związków – do każdej probówki roztwór innej substancji. Zawartość każdej probówki wymieszano. Przebieg doświadczenia zilustrowano na poniższym rysunku.
Rozstrzygnij, czy zmiany zaobserwowane podczas doświadczenia umożliwiają potwierdzenie, że do danej probówki wprowadzono roztwór wskazany na rysunku. Odpowiedź uzasadnij. W uzasadnieniu opisz możliwe do zaobserwowania zmiany zawartości probówek, uwzględnij rodzaj (roztwór, zawiesina) oraz barwę mieszaniny otrzymanej po dodaniu roztworu danej substancji do każdej probówki.
Rozstrzygnięcie:
Uzasadnienie:
Probówka I:
Probówka II:
Probówka III:
Probówka IV: