Informator CKE, Poziom rozszerzony (Formuła 2023) - Zadanie 3. (2 pkt)
Paklitaksel to związek chemiczny wyizolowany z kory cisa krótkolistnego (Taxus brevifolia). Stosuje się go w leczeniu m.in. raka sutka, jajnika i płuc. Działanie paklitakselu polega na stabilizacji mikrotubul i zahamowaniu ich depolimeryzacji, co uniemożliwia ich skracanie. Apigenina jest flawonem występującym m.in. w kwiatach rumianku, pietruszce i selerze.
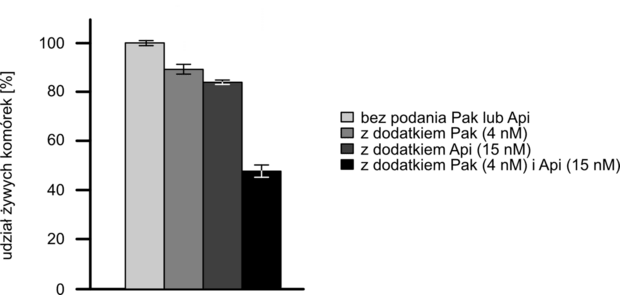
Poniżej przedstawiono wykres ilustrujący odsetek komórek nowotworowych, które pozostały żywe po 24 godzinach od podania paklitakselu (Pak), apigeniny (Api) lub obu związków razem (Pak i Api).
Słupki błędów wskazują odchylenie standardowe, a symbol ** oznacza, że wartość średnia dla próby badawczej różniła się istotnie statystycznie od wartości średniej uzyskanej w próbie kontrolnej (p < 0,01).
3.1. (0–1)
Dokończ zdanie. Zaznacz odpowiedź A, B albo C oraz jej uzasadnienie 1., 2. albo 3.
Paklitaksel jest przyczyną zatrzymania cyklu komórkowego w fazie
| A. | S, | ponieważ | 1. | chromatydy siostrzane nie mogą być rozdzielone. |
| B. | G2, | 2. | hamuje on syntezę DNA. | |
| C. | M, | 3. | powoduje on wydłużanie mikrotubul. |
3.2. (0–1)
Uzupełnij poniższe zdania tak, aby powstał poprawny opis interpretacji przedstawionego wykresu. W każdym nawiasie podkreśl właściwe określenie.
Paklitaksel i apigenina podane razem powodują, że po 24 godzinach przeżywa średnio około (50% / 80%) komórek. Na podstawie wykresu zamieszczonego we wprowadzeniu do zadania można stwierdzić, że podanie paklitakselu i apigeniny (razem / oddzielnie) będzie – średnio rzecz biorąc – skuteczniejsze w terapii raka niż podawanie ich (razem / oddzielnie).