Chemia - Test diagnostyczny (matura próbna) Grudzień 2024, Poziom rozszerzony (Formuła 2023)
Zadanie 1. (3 pkt)
Atomy pierwiastków chemicznych mogą występować w różnych stanach energetycznych. Stan o najniższej energii nazywa się stanem podstawowym, a stany o wyższych energiach to stany wzbudzone.
Atom X w stanie podstawowym ma elektrony rozmieszczone na trzech powłokach. Poza tym wiadomo, że dwie podpowłoki należące do zewnętrznej powłoki nie mają pustych orbitali, a jedna z nich zawiera dwa niesparowane elektrony.
1.1. (0–1)
W pewnych warunkach atom X w stanie podstawowym pochłonął energię. Nastąpiła zmiana stanu energetycznego tylko jednego elektronu, co spowodowało wzrost liczby niesparowanych elektronów w tym atomie. Przed wzbudzeniem stan tego elektronu był opisywany wartościami liczb kwantowych 𝑛=3, 𝑙=1, a po wzbudzeniu zmieniła się tylko wartość liczby pobocznej (orbitalnej).
Uzupełnij poniższy schemat, tak aby przedstawiał on klatkowy zapis konfiguracji elektronowej atomu X w opisanym stanie wzbudzonym.
1.2. (0–2)
Uzupełnij poniższą tabelę. Wpisz symbol pierwiastka X, numer okresu i numer grupy w układzie okresowym oraz symbol bloku konfiguracyjnego, do którego należy pierwiastek X.
| Symbol pierwiastka | Numer okresu | Numer grupy | Symbol bloku |
|---|---|---|---|
Zadanie 2. (1 pkt)
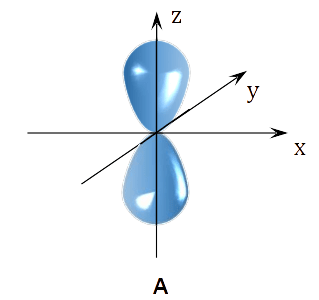
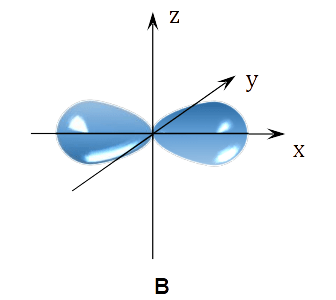
Na poniższym rysunku przedstawiono kontury dwóch orbitali atomowych A i B należących do tej samej podpowłoki elektronowej.
Uzupełnij zdania dotyczące przedstawionych na rysunku orbitali atomowych A i B.
Najmniejsza wartość głównej liczby kwantowej 𝑛, która może opisywać każdy z przedstawionych orbitali, wynosi .
Orbital A i orbital B różnią się wartością liczby kwantowej
oznaczonej symbolem .
Zadanie 3. (2 pkt)
Atomy tlenu i atomy fluoru tworzą aniony o konfiguracji tego samego gazu szlachetnego. W tabeli przedstawiono modele atomu tlenu i atomu fluoru oraz ich prostych jonów. Dana barwa modelu odnosi się do konkretnego pierwiastka.
Uzupełnij tabelę. Napisz symbol atomu lub wzór jonu, który odpowiada każdemu z przedstawionych modeli.
Zadanie 4. (2 pkt)
Reakcja syntezy amoniaku przebiega zgodnie z równaniem:
N2 (g) + 3H2 (g) ⇄ 2NH3 (g)
W temperaturze T i pod ciśnieniem p do syntezy amoniaku użyto 8,0 dm3 mieszaniny azotu i wodoru, w której objętość azotu stanowiła 25%. Stwierdzono, że w wyniku reakcji otrzymano 5,0 dm3 mieszaniny gazów w stanie równowagi (wszystkie gazy odmierzono w tych samych warunkach).
Oblicz wydajność reakcji syntezy amoniaku w opisanych warunkach. Wynik zapisz w procentach.
Zadanie 5. (1 pkt)
Poniżej przedstawiono przebieg przemiany jądrowej, która zachodzi w wyniku bombardowania jąder pewnego izotopu uranu przyśpieszonymi cząstkami 𝛼.
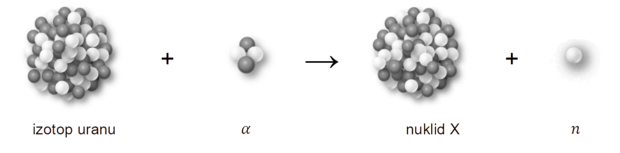
Powstający nuklid X jest nietrwały i ulega rozpadowi β–, którego produktem jest izotop ameryku 241Am.
Napisz równanie opisanej przemiany jądrowej, w której powstaje nuklid X. Uzupełnij wszystkie pola w poniższym schemacie. Zastosuj symbole chemiczne pierwiastków.
Zadanie 6. (3 pkt)
Dwa pierwiastki umownie oznaczone symbolami E i X tworzą jony proste o wzorach E2+
i X2–. Oba te jony mają konfigurację neonu.
Na poniższym modelu przedstawiono budowę kryształu substancji o wzorze ogólnym EX.
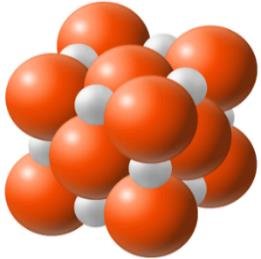
6.1. (0–2)
Napisz wzór związku, którego model przedstawiono powyżej. Użyj symboli chemicznych pierwiastków.
Wzór związku:
Wyjaśnij, dlaczego jon E2+ ma mniejszy promień niż jon X2–. W wyjaśnieniu odwołaj się do budowy tych jonów.
Wyjaśnienie:
6.2. (0–1)
Rozstrzygnij, czy krystaliczna substancja EX jest przewodnikiem czy izolatorem prądu elektrycznego. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 7. (6 pkt)
Chlorek fosforu(V) o wzorze PCl5 ulega rozkładowi zgodnie z równaniem:
PCl5 (g) ⇄ PCl3 (g) + Cl2 (g) Δ𝐻 > 0
7.1. (0–4)
Do cylindrycznego reaktora z ruchomym tłokiem wprowadzono 25,0 g stałego chlorku fosforu(V) i wypompowano całe powietrze. Zawartość reaktora ogrzano do temperatury 260 °C, co początkowo spowodowało sublimację całego chlorku fosforu(V), a w dalszej kolejności jego rozkład termiczny. W układzie utrzymywano stałe ciśnienie równe 1013 hPa, natomiast zmianie ulegała objętość mieszaniny gazów w reaktorze. W chwili 𝑡 w układzie ustaliła się równowaga. Gęstość równowagowej mieszaniny gazów w reaktorze wynosiła 𝑑=2,63 g∙dm−3.
Oblicz wartość stężeniowej stałej równowagi reakcji dysocjacji termicznej chlorku fosforu(V) w temperaturze 260 °C. Przyjmij: R = 83,14 hPa ∙ dm3 ∙ mol–1 ∙ K–1, MPCl5 = 208,5 g ∙ mol–1, MPCl3 = 137,5 g ∙ mol–1.
7.2. (0–2)
Na poniższym wykresie przedstawiono zmianę stężenia molowego chlorku fosforu(V) PCl5 w trakcie – opisanej w informacji wstępnej – reakcji prowadzonej w temperaturze 260 °C.
Tę reakcję przeprowadzono ponownie w tym samym reaktorze. Zmieniono jedynie temperaturę, w której znajdował się układ – wynosiła ona 400 °C.
Poniżej zestawiono wykresy przedstawiające zależność stężenia PCl5 od czasu. Osie na wszystkich wykresach są wyskalowane tak samo.
Rozstrzygnij, na którym z poniższych wykresów (1.–4.) niebieska linia przedstawia zmianę stężenia molowego chlorku fosforu(V) PCl5 w trakcie reakcji prowadzonej w wyższej temperaturze. Odpowiedź uzasadnij – zapisz dwa różne argumenty.
Rozstrzygnięcie:
Argumenty:
Zadanie 8. (1 pkt)
Zbadano, jak w warunkach izotermicznych (𝑇=const) stężenia reagentów X i Y wpływają na szybkość reakcji chemicznej:
X (g) + Y (g) → XY (g)
Ogólne równanie kinetyczne opisanej reakcji ma postać:
v = k ∙ c𝒂X∙𝑐𝒃Y
Ustalono, że:
- stężenie reagenta X nie ma wpływu na szybkość reakcji
- szybkość reakcji zależy od stężenia reagenta Y w sposób przedstawiony na wykresie.
Uzupełnij zdania. Zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Dla opisanej reakcji wartość liczbowa wykładnika 𝒂 w równaniu kinetycznym jest równa (0 / 1 / 2), natomiast wykładnika 𝒃 jest równa (1 / 2 / 3). Jeżeli w warunkach izotermicznych pojemność reaktora, w którym jest prowadzona reakcja, zostanie zwiększona, to szybkość reakcji (wzrośnie / zmaleje / nie ulegnie zmianie).
Zadanie 9. (2 pkt)
Przeprowadzono doświadczenie, w którym do probówki z wodnym roztworem soli pewnego metalu M (zdjęcie 1.), wprowadzono wodny roztwór wodorotlenku potasu o niewielkim stężeniu (etap I) i stwierdzono, że wytrącony osad nie roztwarza się w nadmiarze odczynnika (zdjęcie 2.). Do otrzymanej mieszaniny wkroplono stężony wodny roztwór amoniaku (etap II). W wyniku reakcji powstały jony o wzorze [M(NH3)4]2+. Wygląd zawartości probówki po zakończeniu doświadczenia przedstawiono na zdjęciu 3.
Spośród soli, których wzory wymieniono poniżej, zaznacz tę, której roztwór mógł znajdować się w probówce na początku doświadczenia.
Napisz w formie jonowej skróconej równanie reakcji, która zaszła w etapie I opisanego doświadczenia.
Napisz w formie jonowej równanie reakcji, która zaszła w etapie II opisanego doświadczenia.
Zadanie 10. (3 pkt)
Wodorotlenki metali ciężkich są nietrwałe i łatwo ulegają rozkładowi. W celu zbadania jednej z takich reakcji przeprowadzono następujące doświadczenie: w warunkach beztlenowych z roztworu FeCl2 wytrącono wodorotlenek żelaza(II). Po pewnym czasie stwierdzono, że z mieszaniny poreakcyjnej wydziela się bezbarwny gaz, który zapala się wybuchowo. Po ustaniu objawów reakcji jej stały produkt odsączono i całkowicie usunięto z niego wodę. Badanie składu tego związku wykazało, że jest to tlenek, zawierający 72,36% masowych żelaza.
10.1. (0–2)
Na podstawie obliczeń ustal wzór otrzymanego tlenku żelaza.
10.2. (0–1)
Napisz w formie cząsteczkowej równanie reakcji rozkładu wodorotlenku żelaza(II), której produktem jest opisany tlenek.
Zadanie 11. (3 pkt)
Molową entalpię spalania butan-1-olu można wyznaczyć doświadczalnie. W tym celu szklany palnik napełnia się butan-1-olem, a następnie waży. Za pomocą tak przygotowanego palnika ogrzewa się kolbę zawierającą wodę o znanej masie. Proces spalania alkoholu prowadzi się przez pewien czas, przy czym stale kontroluje się za pomocą termometru temperaturę wody w kolbie. Na zakończenie doświadczenia palnik waży się powtórnie.
Przeprowadzono opisane doświadczenie i na podstawie zmiany temperatury wody określono, że w tym doświadczeniu woda pobrała 𝑄 = 50 400 J energii cieplnej pochodzącej ze spalania butan-1-olu.
W tabeli poniżej zestawiono dane z pomiaru masy palnika podczas doświadczenia.
| Masa palnika napełnionego butan-1-olem | 219,80 g |
| Masa palnika po zakończeniu doświadczenia | 218,32 g |
11.1. (0–1)
Napisz równanie reakcji spalania całkowitego butan-1-olu. Zastosuj wzory sumaryczne substratów i produktów.
11.2. (0–2)
Na podstawie efektu cieplnego reakcji (𝑄) można obliczyć entalpię reakcji (Δ𝐻).
Oblicz molową entalpię spalania butan-1-olu. Pomiń straty ciepła. Wynik zapisz w zaokrągleniu do liczb całkowitych oraz z jednostką kJ·mol‒1. Uwzględnij odpowiedni znak entalpii reakcji.
Zadanie 12. (1 pkt)
W wyniku kontaktu ze skałami i z glebą woda wzbogaca się m.in. w związki wapnia. Obecność tych związków w wodzie jest przyczyną zwiększonej twardości. Twardość węglanową (przemijającą) można usunąć przez gotowanie, co prowadzi do przechodzenia wodorowęglanu wapnia w osad węglanu.
Napisz w formie jonowej równanie reakcji, która zachodzi podczas gotowania twardej wody zawierającej wodorowęglan wapnia.
Zadanie 13. (1 pkt)
W wyniku kontaktu ze skałami i z glebą woda wzbogaca się m.in. w związki wapnia. Obecność tych związków w wodzie jest przyczyną zwiększonej twardości. Twardość węglanową (przemijającą) można usunąć przez gotowanie, co prowadzi do przechodzenia wodorowęglanu wapnia w osad węglanu.
Głównym składnikiem skał wapiennych jest związek chemiczny, występujący w dwóch odmianach krystalicznych, znanych jako kalcyt i aragonit. Na poniższym wykresie przedstawiono zależność iloczynu rozpuszczalności (𝐾s) kalcytu i aragonitu od temperatury. Iloczyn rozpuszczalności jest wyrażony jako p𝐾s (p𝐾s= –log 𝐾s).
Uzupełnij poniższe zdania. Zaznacz jedną odpowiedź spośród podanych w każdym nawiasie.
Wraz ze wzrostem temperatury rozpuszczalność kalcytu i aragonitu w wodzie
(rośnie / maleje). W danej temperaturze rozpuszczalność aragonitu jest (większa / mniejsza) niż rozpuszczalność kalcytu.
Zadanie 14. (2 pkt)
Do 400 cm3 roztworu kwasu azotowego(V) o pH=2,5 wprowadzono 120,0 mg tlenku wapnia, który po chwili roztworzył się całkowicie. Doświadczenie wykonano w temperaturze 𝑡=25 °C.
Oblicz pH otrzymanego roztworu. Załóż, że dodatek tlenku wapnia nie zmienił objętości roztworu. Wynik zapisz w zaokrągleniu do jednego miejsca po przecinku.
Zadanie 15. (3 pkt)
W czterech zlewkach znajdowały się – w losowej kolejności – bezbarwne wodne roztwory różnych soli: węglanu sodu, azotanu(V) ołowiu(II), jodku potasu i siarczanu(VI) cynku. W każdej zlewce był roztwór innej soli. Roztwory tych soli oznaczono numerami I–IV. W celu identyfikacji zawartości każdej zlewki przeprowadzono dwuetapowe doświadczenie.
Etap 1. Roztwór I wprowadzono do trzech probówek, a następnie do każdej z nich dodano po około 2 cm3 roztworu II, III i IV. Analogicznie postąpiono z pozostałymi roztworami:
- do roztworu II dodano roztwory I, III i IV
- do roztworu III dodano roztwory I, II i IV
- do roztworu IV dodano roztwory I, II i III.
Wyniki doświadczenia przedstawiono w tabeli.
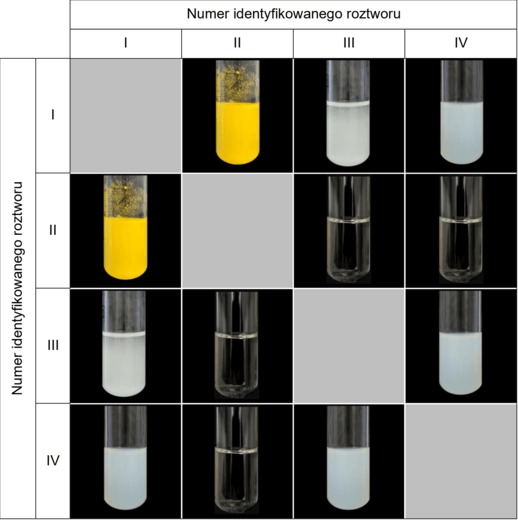
Etap 2. Niewielkie objętości roztworów I–IV przelano do czterech probówek i zbadano ich odczyn przy użyciu alkoholowego roztworu błękitu bromotymolowego. Poniżej przedstawiono wyniki przeprowadzonego doświadczenia.
15.1. (0–2)
Napisz w formie jonowej skróconej równania reakcji, które zaszły przy użyciu roztworu III w etapie 1. przeprowadzonego doświadczenia.
15.2. (0–1)
Napisz równanie reakcji decydującej o odczynie roztworu IV. Wpisz do schematu wzory odpowiednich drobin. Zastosuj definicję kwasu i zasady Brønsteda.
Zadanie 16. (3 pkt)
Poniższe równanie opisuje reakcję kationów miedzi(II) z metalicznym niklem.
Cu2+(aq) + Ni (s) → Ni2+(aq) + Cu (s)
Ta przemiana może zachodzić w różnych układach, np.:
- w roztworze soli miedzi(II) po zanurzeniu w nim blaszki niklowej
- w ogniwie złożonym z odpowiednich półogniw metalicznych.
16.1. (0–2)
Przygotowano wodny roztwór CuSO4 o stężeniu 0,50 mol ∙ dm–3 i objętości 20,0 cm3. W tym roztworze zanurzono niklową płytkę o masie 5,820 g. Po pewnym czasie płytkę wyjęto i osuszono. Stwierdzono, że:
- po zakończeniu doświadczenia stężenie jonów Cu2+ w roztworze wynosiło 0,040 mol∙dm–3
- w warunkach doświadczenia cały wydzielony metal osadził się na płytce.

Oblicz masę płytki po wyjęciu jej z roztworu i osuszeniu. Załóż, że objętość roztworu nie uległa zmianie. W obliczeniach przyjmij następujące wartości mas molowych:
MCu= 63,55 g ∙ mol−1 i MNi = 58,69 g ∙ mol−1.
16.2. (0–1)
Skonstruowano ogniwo elektrochemiczne złożone ze standardowego półogniwa miedziowego oraz standardowego półogniwa niklowego. Półogniwa połączono kluczem elektrolitycznym w formie U-rurki wypełnionej nasyconym roztworem azotanu(V) potasu.
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.
| 1. | Siła elektromotoryczna opisanego ogniwa w warunkach standardowych jest równa 0,216 V. | P | F |
| 2. | W trakcie pracy opisanego ogniwa kationy potasu przemieszczają się z klucza elektrolitycznego w kierunku półogniwa miedziowego, a aniony azotanowe(V) – w kierunku półogniwa niklowego. | P | F |
Zadanie 17. (1 pkt)
Roztwarzanie tlenków wanadu (VO, V2O3, VO2, V2O5) w kwasach nie zawsze prowadzi do powstania prostych kationów wanadu, takich jak V2+ lub V3+, gdyż ten pierwiastek na wyższych stopniach utlenienia tworzy jony oksowanadowe, takie jak VO+2 lub VO2+.
Po zmieszaniu roztworu zawierającego kationy VO+2 z roztworem zawierającym kationy V2+ w środowisku kwasowym zachodzi reakcja, którą można opisać równaniem:
VO+2 (aq) + V2+ (aq) + 2H3O+ (aq) → VO2+ (aq) + V3+ (aq) + 3H2O (c)
W poniższej tabeli podano równania dwóch reakcji:
| I | VO+2 (aq) + 2H3O+ (aq) + e– ⇄ VO2+ (aq) + 3H2O (c) |
| II | V3+ (aq) + e– ⇄ V2+ (aq) |
Rozstrzygnij, która reakcja – I czy II – charakteryzuje się wyższą wartością standardowego potencjału redukcji. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 18. (3 pkt)
Poniżej przedstawiono model przestrzenny cząsteczki pewnego węglowodoru X.
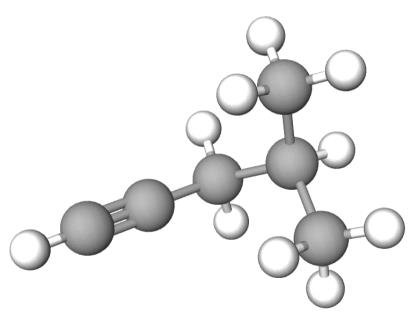
18.1. (0–1)
Napisz nazwę systematyczną węglowodoru X.
18.2. (0–1)
Uzupełnij tabelę. Wpisz liczbę atomów węgla o hybrydyzacji orbitali walencyjnych typu sp3 oraz liczbę wiązań typu 𝝅 w cząsteczce węglowodoru X.
| Hybrydyzacja orbitali atomowych typu sp3 | Wiązanie typu 𝜋 | ||
| Liczba atomów węgla | Liczba wiązań | ||
18.3. (0–1)
Spośród poniżej przedstawionych modeli zaznacz wszystkie te, które przedstawiają izomery węglowodoru X i których cząsteczki są chiralne.
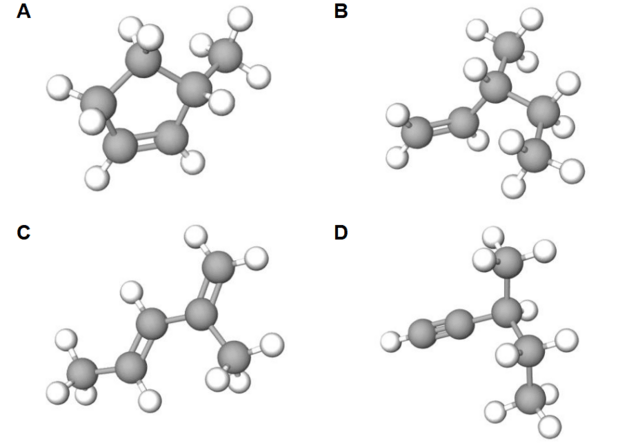
Zadanie 19. (1 pkt)
Przeprowadzono trzyetapowe doświadczenie.
Etap 1. W probówce zmieszano bezbarwne wodne roztwory bromianu(V) potasu oraz bromku potasu. Następnie do mieszaniny dodano kilka kropli kwasu siarkowego(VI). Na zdjęciu obok przedstawiono wynik tego etapu doświadczenia.

Etap 2. Do mieszaniny otrzymanej w etapie 1. wprowadzono toluen – metylobenzen – (𝑑 = 0,86 g ∙ cm−3). Probówkę zamknięto korkiem, a następnie ciecze wymieszano. Na zdjęciach obok przedstawiono wygląd zawartości probówki przed wymieszaniem oraz po wymieszaniu.
Etap 3. Otrzymaną w etapie 2. mieszaninę pozostawiono na pewien czas w nasłonecznionym miejscu. Na zdjęciu obok przedstawiono wynik tego etapu doświadczenia.

Napisz w formie jonowej skróconej równanie reakcji zachodzącej podczas etapu 1. przeprowadzonego doświadczenia.
Zadanie 20. (2 pkt)
Przeprowadzono trzyetapowe doświadczenie.
Etap 1. W probówce zmieszano bezbarwne wodne roztwory bromianu(V) potasu oraz bromku potasu. Następnie do mieszaniny dodano kilka kropli kwasu siarkowego(VI). Na zdjęciu obok przedstawiono wynik tego etapu doświadczenia.

Etap 2. Do mieszaniny otrzymanej w etapie 1. wprowadzono toluen – metylobenzen – (𝑑 = 0,86 g ∙ cm−3). Probówkę zamknięto korkiem, a następnie ciecze wymieszano. Na zdjęciach obok przedstawiono wygląd zawartości probówki przed wymieszaniem oraz po wymieszaniu.
Etap 3. Otrzymaną w etapie 2. mieszaninę pozostawiono na pewien czas w nasłonecznionym miejscu. Na zdjęciu obok przedstawiono wynik tego etapu doświadczenia.

Sformułuj wniosek wynikający z etapu 2. przeprowadzonego doświadczenia. Uwzględnij w nim rozpuszczalność w wodzie i w toluenie barwnej substancji otrzymanej w etapie 1. tego doświadczenia. Nazwij proces, który spowodował zmianę wyglądu zawartości probówki po wymieszaniu i ponownym rozdzieleniu się cieczy.
Wniosek:
Nazwa procesu:
Zadanie 21. (1 pkt)
Przeprowadzono trzyetapowe doświadczenie.
Etap 1. W probówce zmieszano bezbarwne wodne roztwory bromianu(V) potasu oraz bromku potasu. Następnie do mieszaniny dodano kilka kropli kwasu siarkowego(VI). Na zdjęciu obok przedstawiono wynik tego etapu doświadczenia.

Etap 2. Do mieszaniny otrzymanej w etapie 1. wprowadzono toluen – metylobenzen – (𝑑 = 0,86 g ∙ cm−3). Probówkę zamknięto korkiem, a następnie ciecze wymieszano. Na zdjęciach obok przedstawiono wygląd zawartości probówki przed wymieszaniem oraz po wymieszaniu.
Etap 3. Otrzymaną w etapie 2. mieszaninę pozostawiono na pewien czas w nasłonecznionym miejscu. Na zdjęciu obok przedstawiono wynik tego etapu doświadczenia.

Napisz równanie reakcji, która zaszła podczas etapu 3. przeprowadzonego doświadczenia, jeśli stosunek molowy reagentów wynosi 1:1. Zastosuj wzory półstrukturalne (grupowe) lub uproszczone związków organicznych.
Zadanie 22. (1 pkt)
Związek chemiczny o nazwie 2-metyloprop-1-en (izobutylen) jest ważnym surowcem w syntezach organicznych. Przeprowadzono dwie reakcje z udziałem 2-metyloprop-1-enu jako substratu. W reakcji I ten związek poddano polimeryzacji i otrzymano poliizobutylen. W reakcji II przeprowadzono addycję bromowodoru do 2-metyloprop-1-enu.
Uzupełnij schemat tak, aby przedstawiał równanie reakcji otrzymywania poliizobutylenu.
Zadanie 23. (2 pkt)
Związek chemiczny o nazwie 2-metyloprop-1-en (izobutylen) jest ważnym surowcem w syntezach organicznych. Przeprowadzono dwie reakcje z udziałem 2-metyloprop-1-enu jako substratu. W reakcji I ten związek poddano polimeryzacji i otrzymano poliizobutylen. W reakcji II przeprowadzono addycję bromowodoru do 2-metyloprop-1-enu.
Addycja bromowodoru do 2-metyloprop-1-enu zachodzi zgodnie z dwuetapowym mechanizmem ukazanym na poniższym schemacie.
Na wykresie przedstawiono zmianę energii potencjalnej drobin podczas przebiegu reakcji chemicznej.
23.1. (0–1)
Oceń prawdziwość poniższych zdań. Zaznacz P, jeśli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.
| 1. | Entalpia reakcji addycji bromowodoru do 2-metyloprop-1-enu przyjmuje wartość ujemną (Δ𝐻 < 0). | P | F |
| 2. | Reakcja addycji bromowodoru do 2-metyloprop-1-enu zachodzi zgodnie z mechanizmem nukleofilowym. | P | F |
23.2. (0–1)
Szybkość reakcji chemicznej zależy od szybkości najwolniejszego etapu danej przemiany.
Rozstrzygnij, który etap – 1 czy 2 – jest wolniejszy, więc decyduje o szybkości reakcji addycji bromowodoru do 2-metyloprop-1-enu. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 24. (1 pkt)
Propan-2-on (aceton) to powszechnie stosowany rozpuszczalnik organiczny, który miesza się z wodą bez ograniczeń. Propan-2-on można otrzymać m.in.:
- w wyniku addycji wody do odpowiedniego węglowodoru w środowisku kwasowym i w obecności jonów Hg2+
- podczas utleniania odpowiedniego alkoholu.
Uzupełnij poniższe zdania. Zaznacz jedną odpowiedź spośród podanych w każdym
nawiasie.
W ciekłym propanonie najsilniejszymi oddziaływaniami międzycząsteczkowymi są (wiązania
wodorowe / oddziaływania dipolowe).
W wodnym roztworze propanonu pomiędzy cząsteczkami tego związku a cząsteczkami
wody (tworzą / nie tworzą) się wiązania wodorowe.
Zadanie 25. (1 pkt)
Propan-2-on (aceton) to powszechnie stosowany rozpuszczalnik organiczny, który miesza się z wodą bez ograniczeń. Propan-2-on można otrzymać m.in.:
- w wyniku addycji wody do odpowiedniego węglowodoru w środowisku kwasowym i w obecności jonów Hg2+
- podczas utleniania odpowiedniego alkoholu.
Uzupełnij poniższy schemat. Napisz wzory półstrukturalne (grupowe) organicznych substratów opisanych reakcji otrzymywania propanonu.
Zadanie 26. (3 pkt)
Aldehydy i ketony, których cząsteczki zawierają co najmniej jeden atom wodoru przy atomie węgla połączonym z grupą karbonylową (atomie węgla 𝛼), w środowisku zasadowym ulegają tzw. reakcji aldolowej. Ta reakcja prowadzi do połączenia dwóch cząsteczek aldehydów lub ketonów i do utworzenia wiązania między atomem węgla α jednej cząsteczki i karbonylowym atomem węgla drugiej cząsteczki. Bezpośrednim produktem reakcji aldolowej jest β-hydroksyaldehyd (aldol) lub β-hydroksyketon.
Na poniżym schemacie zielonym kolorem oznaczono wiązanie C – C utworzone w takiej reakcji.
26.1. (0–1)
Spośród poniższych aldehydów i ketonów wybierz te, które nie ulegają reakcji aldolowej. Zaznacz ich nazwy.
26.2. (0–2)
Przeprowadzono reakcję aldolową pewnego związku karbonylowego (związku A), w wyniku której powstał związek B, będący β-hydroksyketonem. Ten związek uległ następnie dehydratacji (odwodnieniu). Otrzymano dwa produkty organiczne: związek C i związek D.
Uzupełnij poniższe schematy. Napisz:
- wzór półstrukturalny (grupowy) lub uproszczony związku karbonylowego (związek A), z którego powstał przedstawiony 𝛃-hydroksyketon (związek B)
- wzory półstrukturalne (grupowe) lub uproszczone produktów dehydratacji otrzymanego 𝛃-hydroksyketonu (związek B).
Zadanie 27. (1 pkt)
Zbadano właściwości kwasu mrówkowego (metanowego). Przeprowadzono doświadczenie, w którym do probówki z zawiesiną wodorotlenku miedzi(II) wprowadzono wodny roztwór kwasu mrówkowego. Wygląd zawartości probówki przed dodaniem kwasu mrówkowego (zdjęcie 1.) i po jego dodaniu (zdjęcie 2.) przedstawiono poniżej.
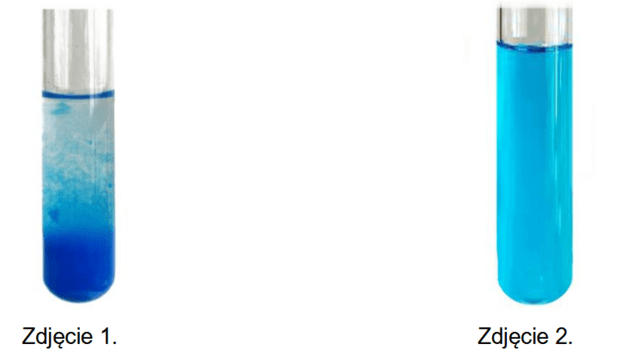
Napisz wzór elektronowy organicznej drobiny, która występuje w produkcie reakcji. Zaznacz kreskami pary elektronowe wiązań chemicznych oraz wolne pary elektronowe.
Zadanie 28. (1 pkt)
Ester o podanym poniżej wzorze poddano reakcji hydrolizy z nadmiarem wodnego roztworu wodorotlenku potasu.
Uzupełnij schemat. Napisz w formie jonowej skróconej równanie reakcji hydrolizy zasadowej, której uległ przedstawiony ester.
Zadanie 29. (1 pkt)
Kwas asparaginowy w roztworze wodnym może występować w postaci czterech form jonowych różniących się ładunkiem.
Wodny roztwór kwasu asparaginowego zakwaszono do pH = 1, a następnie miareczkowano roztworem wodorotlenku sodu. Podczas tego procesu kwas asparaginowy ulegał deprotonacji zgodnie z poniższym schematem:
Asp+ OH–1. Asp0 OH–2. Asp– OH–3. Asp2–
W powyższym schemacie zaznaczono sumaryczne ładunki elektryczne poszczególnych form tego aminokwasu. Forma kwasu asparaginowego oznaczona Asp0 to jon obojnaczy.
Napisz równanie reakcji 2. zachodzącej podczas przemiany jonu obojnaczego Asp0 w jon Asp–. Uzupełnij poniższy schemat. Wpisz wzory brakujących grup.
Zadanie 30. (2 pkt)
W celu zidentyfikowania aminokwasów białkowych, których reszty wchodzą w skład pewnego dipeptydu X, przeprowadzono dwuetapową analizę.
Etap 1. Próbkę dipeptydu X poddano reakcji całkowitego spalania, której produktami były tlenek węgla(IV), azot i para wodna. Stosunek molowy substratów i produktów biorących udział w tej przemianie jest następujący:
𝑛dipeptyd X ∶ 𝑛O2 ∶ 𝑛CO2 ∶ 𝑛N2 ∶ 𝑛H2O = 4 ∶ 43 ∶ 32 ∶ 6 ∶ 34
Etap 2. Drugą próbkę badanego dipeptydu poddano hydrolizie i ustalono, że jeden z aminokwasów był związkiem achiralnym.
Wykonaj obliczenia i ustal wzór sumaryczny dipeptydu X. Napisz nazwę chiralnego aminokwasu, którego reszta wchodzi w skład dipeptydu.
Wzór sumaryczny dipeptydu X: CHNO
Nazwa aminokwasu chiralnego:
Zadanie 31. (2 pkt)
Poniżej przedstawiono – w projekcji Hawortha – wzór pewnej formy tagatozy.
31.1. (0–1)
Zaznacz prawidłową nazwę przedstawionej formy D-tagatozy.
31.2. (0–1)
Dokończ zdanie. Zaznacz odpowiedź A albo B oraz uzasadnienie 1., 2. albo 3.
Na podstawie przedstawionego wzoru stereochemicznego tagatozy można stwierdzić, że ten cukier jest
| A. | aldozą, | ponieważ | 1. | anomeryczny atom węgla jest związany bezpośrednio z grupą hydroksylową. |
| 2. | anomeryczny atom węgla jest związany z grupą –CH2OH. | |||
| B. | ketozą, | |||
| 3. | w skład pierścienia wchodzi pięć atomów. |