Test diagnostyczny (matura próbna) Grudzień 2024, Poziom rozszerzony (Formuła 2023) - Zadanie 27. (1 pkt)
Zbadano właściwości kwasu mrówkowego (metanowego). Przeprowadzono doświadczenie, w którym do probówki z zawiesiną wodorotlenku miedzi(II) wprowadzono wodny roztwór kwasu mrówkowego. Wygląd zawartości probówki przed dodaniem kwasu mrówkowego (zdjęcie 1.) i po jego dodaniu (zdjęcie 2.) przedstawiono poniżej.
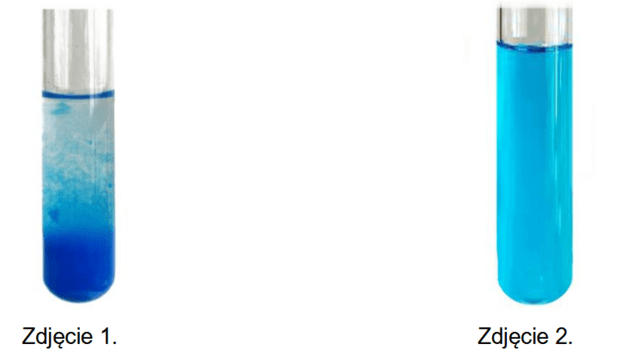
Napisz wzór elektronowy organicznej drobiny, która występuje w produkcie reakcji. Zaznacz kreskami pary elektronowe wiązań chemicznych oraz wolne pary elektronowe.