Zbiór zadań CKE, Poziom rozszerzony (Formuła 2015) - Zadanie 27. (1 pkt)
Podaj wartość pobocznej liczby kwantowej l dla jednego z elektronów walencyjnych atomu chromu, obsadzających najdalej położoną od jądra atomu powłokę elektronową.
Podaj wartość pobocznej liczby kwantowej l dla jednego z elektronów walencyjnych atomu chromu, obsadzających najdalej położoną od jądra atomu powłokę elektronową.
Podaj liczbę elektronów walencyjnych atomu chromu w stanie podstawowym, obsadzających wyłącznie powłokę elektronową opisaną główną liczbą kwantową n=3.
Zapisz pełną konfigurację elektronową atomu chromu w stanie podstawowym.
Poniżej przedstawiono konfigurację elektronową atomów w stanie podstawowym wybranych metali należących do 1. grupy układu okresowego pierwiastków. Metale te oznaczono numerami I, II i III.
Pierwsza energia jonizacji to energia, jaką należy dostarczyć, aby oderwać elektron od obojętnego atomu.
| a) | Zaznacz poprawne dokończenie zdania. |
Najmniejszą pierwszą energię jonizacji ma atom pierwiastka oznaczonego numerem
| b) | Określ liczbę elektronów w rdzeniu atomu metalu oznaczonego numerem III. |
| c) | Napisz wzór sumaryczny związku metalu oznaczonego numerem II z chlorem i określ charakter wiązania chemicznego (jonowe, kowalencyjne niespolaryzowane, kowalencyjne spolaryzowane), które w tym związku występuje. |
Zależnie od tego, czy pierwiastek dąży do tworzenia jonów dodatnich, czy ujemnych, rozróżnia się pierwiastki elektrododatnie i elektroujemne. Pierwiastki elektroujemne mają wiele elektronów walencyjnych, a pobierając elektrony, tworzą jony ujemne o trwałej konfiguracji elektronowej. Pierwiastki elektrododatnie, oddając elektrony, tworzą jony dodatnie o trwałej konfiguracji.
Atom pewnego pierwiastka ma w stanie podstawowym następującą konfigurację elektronową:
1s22s22p63s23p63d54s1
Tlenek i wodorotlenek tego pierwiastka, w których przyjmuje on pewien stopień utlenienia, wykazują właściwości amfoteryczne. Na tym stopniu utlenienia opisany pierwiastek występuje także w postaci jonów prostych.
| a) | Napisz wzór i skróconą konfigurację elektronową tego jonu prostego opisanego pierwiastka. |
| b) | Podaj wartość głównej liczby kwantowej n i wartość pobocznej liczby kwantowej l opisujących stan dowolnego niesparowanego elektronu walencyjnego w tym jonie. |
Pierwiastek X leży w siódmej grupie i czwartym okresie układu okresowego. Pierwiastek ten tworzy jon prosty X2+. Wszystkie atomy pierwiastka X występujące w przyrodzie mają liczbę masową równą 55.
| a) | Napisz skróconą konfigurację elektronową jonu X2+ w stanie podstawowym. |
| b) | Określ i wpisz do tabeli liczbę protonów i neutronów znajdujących się w jądrze atomu pierwiastka X oraz liczbę elektronów tworzących rdzeń atomu tego pierwiastka. |
| Pierwiastek X | Liczba cząstek elementarnych znajdujących się w jądrze atomu X |
Liczba elektronów znajdujących się w rdzeniu atomu X |
Miedź tworzy kationy Cu+ oraz Cu2+.
| a) | Określ, ile elektronów i z jakiej podpowłoki albo podpowłok oddaje atom miedzi, tworząc kation Cu2+. Dokończ poniższe zdanie, wpisując liczbę elektronów i symbol odpowiedniej podpowłoki lub podpowłok. |
Tworzenie kationu Cu2+ oznacza oddanie przez atom miedzi
| b) | Uzupełnij poniższą tabelę, wpisując schemat klatkowy konfiguracji elektronów walencyjnych jonu Cu2+ w stanie podstawowym oraz wartości głównej liczby kwantowej n i pobocznej liczby kwantowej l dla niesparowanego elektronu w tym jonie. |
| Schemat klatkowy elektronów walencyjnych | Główna liczba kwantowa n | Poboczna liczba kwantowa l |
|---|---|---|
Tripeptyd, którego wzór przedstawiono poniżej, jest zbudowany z reszt trzech aminokwasów.
Napisz nazwy zwyczajowe aminokwasów powstanących w wyniku całkowitej hydrolizy przedstawionego tripeptydu.
Mocznik o wzorze CO(NH2)2 jest diamidem kwasu węglowego. W wyniku ogrzewania krystalicznego mocznika wydziela się amoniak i powstaje dimocznik (biuret).
Napisz równanie opisanej reakcji prowadzącej do powstania dimocznika. Zastosuj wzory półstrukturalne (grupowe) związków organicznych. Następnie wybierz i podkreśl nazwę wiązania, które powstało w reakcji kondensacji mocznika, oraz podaj nazwę grupy związków wielkocząsteczkowych, w których występuje takie samo wiązanie.
Równanie reakcji:
Nazwa wiązania:
Nazwa grupy związków:
Przykładem dienu ze sprzężonym układem wiązań podwójnych jest but-1,3-dien o wzorze CH2=CH−CH=CH2 . Długość wiązania między drugim i trzecim atomem węgla w cząsteczce tego związku wskazuje, że ma ono częściowo charakter wiązania podwójnego. Jest to spowodowane delokalizacją elektronów wiązań π: każda para elektronowa tych wiązań jest przyciągana nie przez dwa, lecz przez cztery jądra atomowe. Można powiedzieć, że cząsteczka but-1,3-dienu jest hybrydą, czyli wypadkową (połączeniem w jedną całość) kilku struktur granicznych. Przykładem jednej z nich jest struktura o wzorze
Na podstawie: J.T. Morrison, R.N. Boyd, Chemia organiczna, Warszawa 2008.
W reakcji przyłączania bromu do but-1,3-dienu – przy stosunku molowym substratów 1 : 1 – oprócz związku X, który stanowi 55% produktów, powstaje 1,4-dibromobut-2-en z wydajnością 45%:
Napisz wzór półstrukturalny (grupowy) związku X oraz podaj jego nazwę systematyczną.
Wzór:
Nazwa systematyczna:
Napisz wzór półstrukturalny (grupowy) alkanu o wzorze C6H14, w którego cząsteczce występuje czwartorzędowy atom węgla. Napisz nazwę systematyczną tego alkanu. Określ liczbę monochloropochodnych będących izomerami konstytucyjnymi, które mogą powstać w procesie chlorowcowania opisanego węglowodoru.
Wzór:
Nazwa systematyczna:
Liczba izomerycznych monochloropochodnych:
Przeprowadzono doświadczenie, którego przebieg zilustrowano na schemacie.
W obu probówkach wytrącił się brunatny osad.
14.1. (0–1)
Napisz w formie jonowej z uwzględnieniem oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesu redukcji i procesu utleniania zachodzących w probówce I podczas opisanego doświadczenia. Uwzględnij fakt, że jednym z substratów obu procesów jest woda.
Równanie procesu redukcji:
Równanie procesu utleniania:
14.2. (0–2)
Oceń, jaki jest odczyn roztworu po zakończeniu reakcji w probówce I, oraz podaj nazwę anionu zawierającego siarkę, który powstał w wyniku reakcji chemicznej przebiegającej w probówce II.
Odczyn roztworu po reakcji w probówce I:
Nazwa anionu zawierającego siarkę:
Reakcję syntezy tlenku azotu(II) ilustruje równanie:
N2 (g) + O2 (g) ⇄ 2NO(g)
W tabeli podano wartości stężeniowej stałej równowagi Kc reakcji syntezy NO w różnych temperaturach.
| Temperatura, K | 1000 | 2000 | 3000 | 4000 |
| Kc | 6,8 ⋅ 10−9 | 4,6 ⋅ 10−4 | 1,7 ⋅ 10−2 | 8,3 ⋅ 10−2 |
Na podstawie: K.-H. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007.
Oceń, czy opisana reakcja jest procesem egzo- czy endotermicznym, oraz spośród poniższych sposobów prowadzenia reakcji wybierz ten powodujący zwiększenie wydajności tworzenia tlenku azotu(II).
Opisana reakcja jest procesem
Numer sposobu zwiększenia wydajności tworzenia tlenku azotu(II):
Przygotowano dwie identyczne próbki oznaczone numerami I i II: w każdej próbce zmieszano
2,8 g wiórków żelaznych i 2,4 g rozdrobnionej siarki.
Próbkę I wprowadzono do probówki i ogrzano w płomieniu palnika. Stwierdzono, że żelazo
całkowicie przereagowało z siarką, w wyniku czego powstał produkt, w którym stosunek
masowy mFe : mS ≈ 7 : 4 (reakcja 1.). Po zakończeniu reakcji zawartość probówki ostudzono,
a następnie poddano działaniu kwasu solnego użytego w nadmiarze. Zaobserwowano,
że mieszanina poreakcyjna częściowo roztworzyła się w kwasie, czemu towarzyszyło
wydzielanie bezbarwnego gazu o nieprzyjemnym zapachu (reakcja 2.).
Próbkę II wprowadzono – bez uprzedniego ogrzewania – do zlewki z kwasem solnym.
Stwierdzono, że próbka częściowo roztworzyła się w nadmiarze kwasu z wydzieleniem
bezbarwnego i bezwonnego gazu (reakcja 3.).
7.1. (0–1)
Napisz w formie cząsteczkowej równania reakcji, które zaszły po poddaniu obu próbek działaniu kwasu solnego użytego w nadmiarze (reakcja 2. i reakcja 3.).
Równanie reakcji 2.:
Równanie reakcji 3.:
7.2. (0–1)
Podaj nazwę substancji, która pozostała nieroztworzona w kwasie solnym w obu naczyniach, i podaj nazwę metody, którą należy zastosować, aby wyodrębnić tę substancję z mieszaniny poreakcyjnej otrzymanej po dodaniu nadmiaru kwasu solnego do obu próbek.
Nazwa substancji:
Nazwa metody:
7.3. (0–1)
Ustal, ile gramów substancji, która pozostała nieroztworzona w kwasie solnym w obu naczyniach, zawierały próbki.
Próbka I:
Próbka II:
Wpisz do tabeli symbole chemiczne pierwiastków opisanych niżej.
| 1. | Niemetal, w którego atomie w stanie podstawowym liczba sparowanych elektronów walencyjnych trzeciej powłoki jest dwa razy większa niż liczba elektronów niesparowanych. | |
| 2. | Pierwiastek, którego atom w stanie podstawowym ma następującą konfigurację elektronową: 1s22s22p63s23p64s13d5 . | |
| 3. | Pierwiastek, którego dwudodatni kation w stanie podstawowym ma następującą konfigurację elektronową: 1s22s22p63s23p63d10 . |
Przeprowadzono ciąg przemian opisany poniższym schematem.
A Br2, światło1. CH3‒C(CH3)Br‒CH3 KOH, etanol, T2. B H2O, H2SO43. C (produkt główny)
24.1. (0–1)
Organiczny produkt reakcji 1. ma jeden izomer o takim samym szkielecie węglowym.
Napisz nazwę systematyczną opisanego izomeru organicznego produktu reakcji 1.
24.2. (0–2)
Napisz równanie reakcji prowadzącej do otrzymania związku organicznego oznaczonego na schemacie literą B (reakcji 2. ) oraz równanie reakcji prowadzącej do otrzymania związku organicznego oznaczonego na schemacie literą C (głównego produktu reakcji 3.). Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Równanie reakcji 2.:
Równanie reakcji 3.:
Przeprowadzono doświadczenie zilustrowane poniższym schematem.
Napisz numery wszystkich probówek, w których zaszły reakcje chemiczne.
Gazy powszechnie występujące, ale nadmiernie emitowane w wyniku działalności ludzkiej, takie jak CO2 czy metan, są przyczyną efektu cieplarnianego, którego konsekwencją może być globalne ocieplenie klimatu. W minionym stuleciu wraz ze zwiększaniem się stężenia dwutlenku węgla wzrosła o 0,4–0,7°C globalna temperatura. Podwojenie stężenia atmosferycznego CO2 w stosunku do obecnego poziomu może doprowadzić do dalszego ocieplenia o ok. 3,5°C.
Na podstawie: A. Mackenzie, A.S. Ball, S.R. Virdee, Ekologia. Krótkie wykłady, Warszawa 2009.
| a) | Wykaż, że można zmniejszyć ilość dwutlenku węgla w atmosferze poprzez następujące działania: |
zmianę źródeł energii wykorzystywanych przez człowieka
zalesianie nieużytków.
| b) | Podaj przykład możliwych niekorzystnych zmian środowiska na Ziemi, jeżeli dojdzie do dalszego ocieplania się klimatu. |
Mszyce są owadami, które wysysają sok z łyka roślin. Te soki zawierają dużo wody i cukrów, a mało innych substancji odżywczych. Dlatego mszyce wydalają nadmiar wody z cukrami (tzw. spadź), które są chętnie spijane przez mrówki. Mrówki te zapewniają mszycom ochronę przed ich naturalnymi wrogami – biedronkami.
Ze względu na możliwość wykorzystania biedronki do walki z mszycami sprowadzono do Europy biedronkę azjatycką, która zjada więcej mszyc niż nasza rodzima biedronka siedmiokropka. Biedronka azjatycka żywi się nie tylko mszycami, lecz także larwami innych biedronek.
Na podstawie tekstu zapisz złożony z czterech elementów łańcuch pokarmowy.
Grupy krwi człowieka w układzie AB0 są determinowane przez trzy allele: IA, IB, i. Na poniższym schemacie rodowodu uwzględniono grupy krwi niektórych osób: ojca oznaczonego numerem 1. oraz dwóch córek oznaczonych numerami 3. i 4. Grupy krwi matki oznaczonej numerem 2. i trzeciej córki oznaczonej numerem 5. nie są znane.
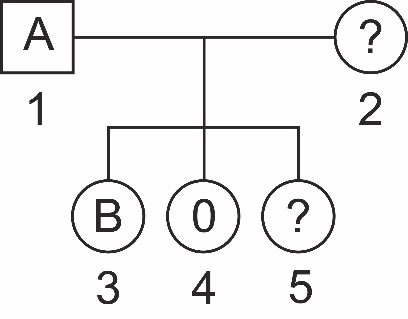
| a) | Podaj genotypy osób oznaczonych numerami 1., 3. i 4., używając symboli alleli podanych w tekście. |
Osoba 1.:
Osoba 3.:
Osoba 4.:
| b) | Podaj genotyp matki i określ jej grupę krwi. |
Genotyp matki:
Grupa krwi matki:
| c) | Oblicz prawdopodobieństwo, że córka oznaczona numerem 5. ma grupę krwi B. Zapisz krzyżówkę genetyczną (szachownicę Punneta). |
Krzyżówka:
Odpowiedź:

BiologHelp+ obejmuje: