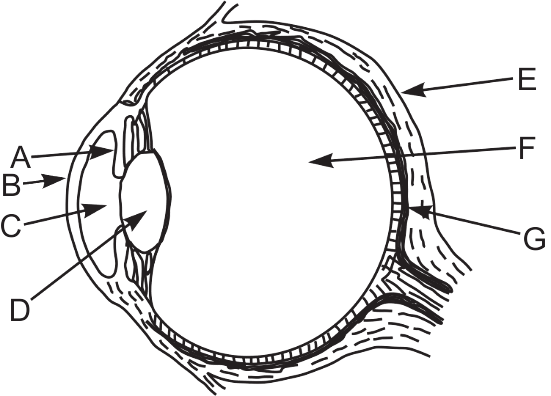
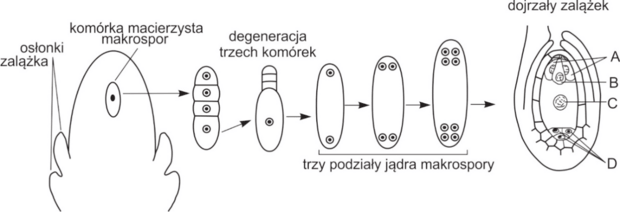
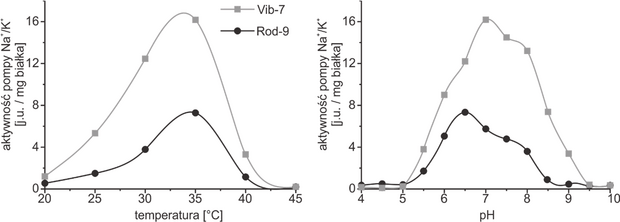
Zbiór zadań CKE, Poziom rozszerzony (Formuła 2015) - Zadanie 91. (2 pkt)
Przeprowadzono doświadczenie zilustrowane schematem:
| a) | Napisz w formie jonowej skróconej równanie reakcji, która zaszła podczas doświadczenia. |
| b) | Podaj, jakie jest stężenie molowe jonów H+ i jonów OH– po zakończeniu doświadczenia, jeżeli w reakcji wzięły udział stechiometryczne ilości reagentów. |