Zbiór zadań CKE, Poziom rozszerzony (Formuła 2015) - Zadanie 160. (2 pkt)
W celu rozróżnienia wodnych roztworów kwasu metanowego (mrówkowego) i kwasu
etanowego (octowego) do probówek z roztworami tych kwasów dodano kilka kropli wodnego
roztworu kwasu siarkowego(VI) i wprowadzono odczynnik X wybrany spośród
następujących: wodny roztwór wodorotlenku sodu, wodny roztwór manganianu(VII) potasu,
wodny roztwór dichromianu(VI) potasu.
Przebieg doświadczenia ilustruje poniższy schemat.
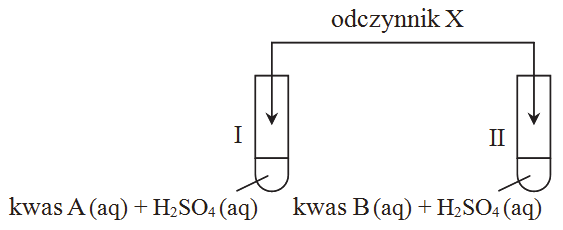
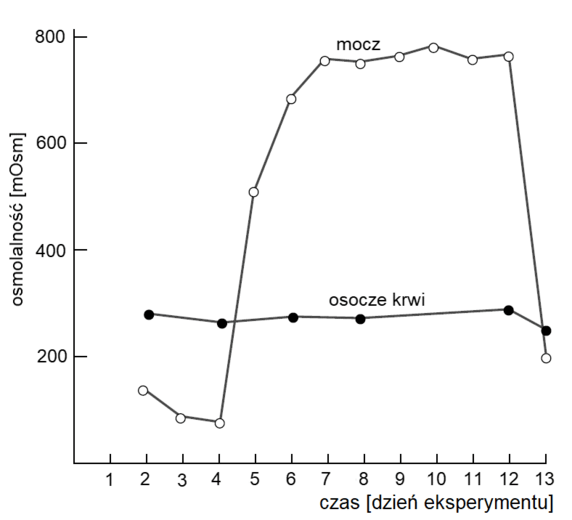
Zaobserwowano, że w probówkach I i II roztwory zabarwiły się na fioletowo. Pod wpływem ogrzewania otrzymany w probówce II roztwór odbarwił się, a mieszanina pieniła się. Stwierdzono, że wydzielał się gaz. Podczas ogrzewania roztworu otrzymanego w probówce I nie zaobserwowano zmian.
160.1 (0-1)
Podaj nazwę lub wzór użytego odczynnika.
160.2 (0-1)
Podaj nazwę kwasu A, którego roztwór znajdował się w probówce I i nazwę kwasu B, którego roztwór znajdował się w probówce II.