Matura Maj 2023, Poziom rozszerzony (Formuła 2015) - Zadanie 10. (3 pkt)
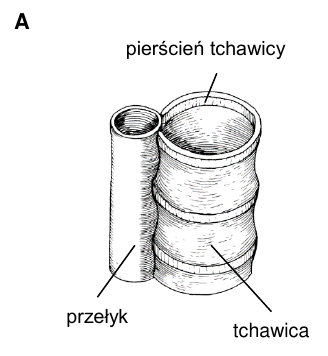
Układ oddechowy człowieka tworzą drogi oddechowe oraz płuca. Tchawica (rysunek A) stanowi odcinek dolnych dróg oddechowych. Pierścienie obecne w ścianie tchawicy mają kształt podkowiasty.
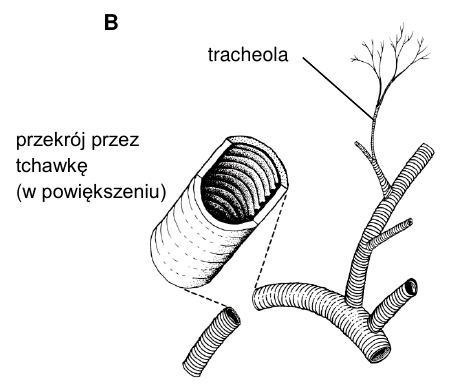
U owadów tlen do komórek ciała jest dostarczany przez układ tchawkowy. Tchawki (rysunek B) stanowią kanały powietrzne, których ścianę tworzy nabłonek będący przedłużeniem epidermy pokrywającej ciało owada. Ten nabłonek wytwarza pokrytą woskami kutykularną wyściółkę tchawki, w której można wyróżnić takie same warstwy jak w kutykuli tworzącej szkielet zewnętrzny owada. Na przekroju tchawki są widoczne pierścieniowe zgrubienia kutykuli.
red. M. Maćkowiak, A. Michalak, Biologia. Jedność i różnorodność, Warszawa 2008.
10.1. (0–1)
Podaj nazwę białka stanowiącego główny składnik pierścieni tchawicy człowieka oraz nazwę polisacharydu stanowiącego główny składnik zgrubień kutykuli w tchawkach owadów.
Białko stanowiące główny składnik pierścieni tchawicy człowieka:
Polisacharyd stanowiący główny składnik zgrubień kutykuli w tchawkach owadów:
10.2. (0–2)
Uzupełnij poniższe zdania tak, aby zawierały informacje prawdziwe dotyczące budowy tchawicy człowieka. W każdym nawiasie podkreśl właściwe określenie.
Tchawica człowieka rozpoczyna się bezpośrednio za (gardłem / krtanią), a na dolnym końcu dzieli się na (oskrzela główne / oskrzeliki). Tylna ściana tchawicy jest spłaszczona i tworzą ją mięśnie (gładkie / poprzecznie prążkowane).