Zadania dodatkowe matury dwujęzycznej (tłumaczenie BiologHelp) Maj 2024, Poziom rozszerzony (Formuła 2023) - Zadanie 13. (1 pkt)
Do probówki z wodnym roztworem chromianu(VI) potasu dodano bezbarwny wodny roztwór pewnej substancji (reakcja 1). Następnie do otrzymanej mieszaniny dodano bezbarwny wodny roztwór innej substancji (reakcja 2). Przebieg eksperymentu zilustrowano na poniższym schemacie.
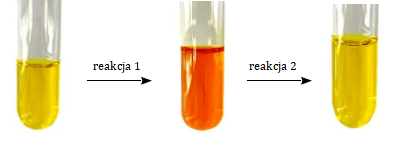
Napisz w formie jonowej skróconej równanie reakcji 2.