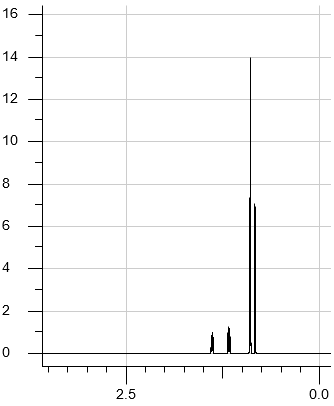
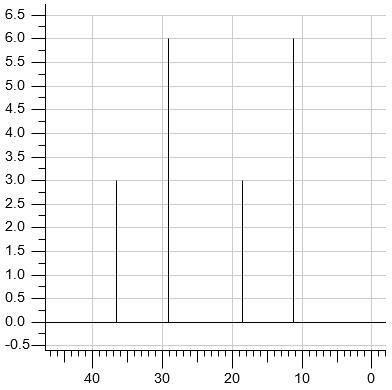
Test diagnostyczny (matura próbna) Grudzień 2024, Poziom rozszerzony (Formuła 2023) - Zadanie 22. (1 pkt)
Związek chemiczny o nazwie 2-metyloprop-1-en (izobutylen) jest ważnym surowcem w syntezach organicznych. Przeprowadzono dwie reakcje z udziałem 2-metyloprop-1-enu jako substratu. W reakcji I ten związek poddano polimeryzacji i otrzymano poliizobutylen. W reakcji II przeprowadzono addycję bromowodoru do 2-metyloprop-1-enu.
Uzupełnij schemat tak, aby przedstawiał równanie reakcji otrzymywania poliizobutylenu.