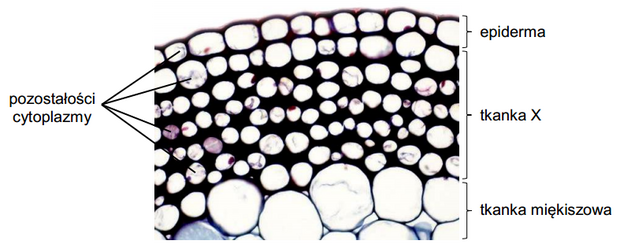
Matura Czerwiec 2022, Poziom rozszerzony (Formuła 2015) - Zadanie 7. (2 pkt)
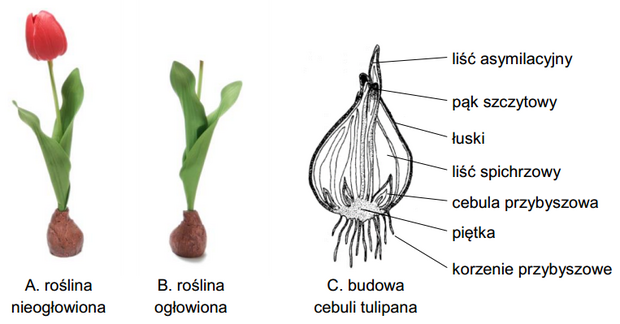
Cebule tulipanów zimują w gruncie, a wiosną wyrastają z nich liście asymilacyjne i kwiaty. Ogławianie cebulowych roślin ozdobnych jest zabiegiem pielęgnacyjnym polegającym na usuwaniu przekwitniętych kwiatów, ale pozostawianiu liści asymilacyjnych aż do ich zaschnięcia. Latem rośliny wchodzą w stan spoczynku. Aby uzyskać większe cebule, producenci cebul tulipanów ogławiają rośliny już na początku ich kwitnienia.
Na poniższej ilustracji przedstawiono pokrój rośliny nieogłowionej i ogłowionej oraz budowę jej cebuli.
Uwaga: Nie zachowano proporcji wielkości struktur.
7.1. (0–1)
Wyjaśnij, dlaczego ogławianie tulipanów skutkuje zwiększeniem masy cebul tych roślin.
7.2. (0–1)
Podaj nazwę organu rośliny, którego modyfikacją jest piętka cebuli.