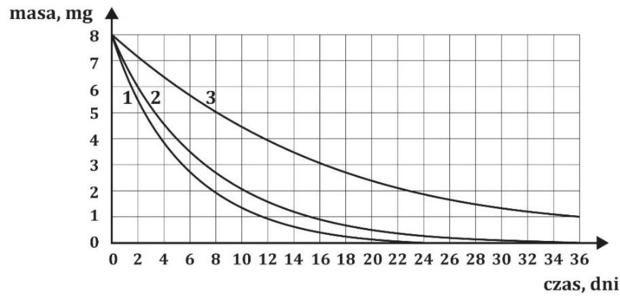
Matura Czerwiec 2021, Poziom rozszerzony (Formuła 2015) - Zadanie 3. (3 pkt)
Na schemacie w sposób uproszczony przedstawiono proces fosforylacji fotosyntetycznej.
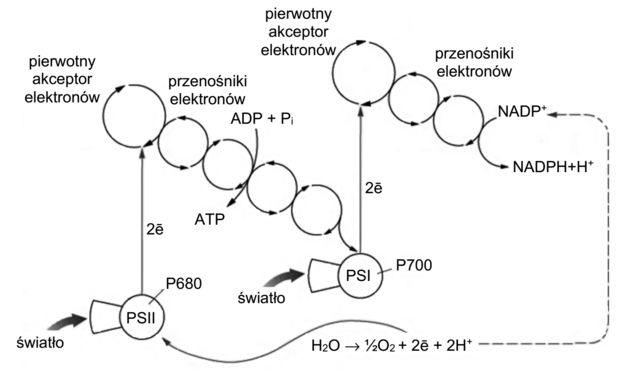
3.1. (0–1)
Wybierz i zaznacz rodzaj fosforylacji fotosyntetycznej przedstawionej na schemacie. Odpowiedź uzasadnij.
- fosforylacja cykliczna
- fosforylacja niecykliczna
Uzasadnienie:
3.2. (0–2)
Wymień dwa produkty procesu przedstawionego na schemacie, które łącznie są określane jako „siła asymilacyjna”, oraz podaj, na jakich etapach fazy fotosyntezy niezależnej od światła każdy z nich jest wykorzystywany.