Chemia - Matura Maj 2021, Poziom rozszerzony (Formuła 2015)
Zadanie 1. (2 pkt)
Dwa pierwiastki, oznaczone numerami 1. i 2., należą do czwartego okresu układu okresowego. Liczba atomowa pierwiastka 1. jest mniejsza od liczby atomowej pierwiastka 2. Atomy (w stanie podstawowym) tych pierwiastków mają 4 elektrony, które mogą uczestniczyć w tworzeniu wiązań chemicznych.
Uzupełnij tabelę. Napisz nazwy pierwiastków 1. i 2. oraz określ, czy w atomach (w stanie podstawowym) tych pierwiastków występują niesparowane elektrony – podaj liczbę elektronów niesparowanych i napisz symbol podpowłoki, do której one należą, albo zaznacz, że nie ma takich elektronów.
| Nazwa | Elektrony niesparowane | ||
| liczba | symbol podpowłoki | ||
| Pierwiastek 1. | |||
| Pierwiastek 2. | |||
Zadanie 2. (1 pkt)
Atomy fluorowców wykazują wyraźną tendencję do przyjęcia dodatkowego elektronu i przejścia w jon X– lub też – gdy różnica elektroujemności fluorowca i łączącego się z nim pierwiastka jest mała – do utworzenia wiązania kowalencyjnego. W szczególnych warunkach może nastąpić oderwanie elektronu od obojętnego atomu fluorowca i utworzenie jonu X+.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Uzupełnij poniższy schemat tak, aby przedstawiał on graficzny zapis konfiguracji elektronowej kationu bromoniowego Br+ (stan podstawowy). W tym zapisie uwzględnij numery powłok i symbole podpowłok.
Zadanie 3. (1 pkt)
Atomy fluorowców wykazują wyraźną tendencję do przyjęcia dodatkowego elektronu i przejścia w jon X– lub też – gdy różnica elektroujemności fluorowca i łączącego się z nim pierwiastka jest mała – do utworzenia wiązania kowalencyjnego. W szczególnych warunkach może nastąpić oderwanie elektronu od obojętnego atomu fluorowca i utworzenie jonu X+.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Spośród wymienionych poniżej substancji wybierz te, w skład których wchodzą jony Cl–. Podkreśl wzory wybranych związków.
Zadanie 4. (3 pkt)
Atomy fluorowców wykazują wyraźną tendencję do przyjęcia dodatkowego elektronu i przejścia w jon X– lub też – gdy różnica elektroujemności fluorowca i łączącego się z nim pierwiastka jest mała – do utworzenia wiązania kowalencyjnego. W szczególnych warunkach może nastąpić oderwanie elektronu od obojętnego atomu fluorowca i utworzenie jonu X+.
Poniżej przedstawiono schematy czterech przemian chemicznych A, B, C i D, w których jednym z substratów jest chlor.
- metan ⟶ chlorometan
- eten ⟶ 1,2-dichloroetan
- benzen ⟶ chlorobenzen
- toluen (metylobenzen) ⟶ chlorofenylometan (C6H5CH2Cl)
4.1. (0–1)
Spośród przemian oznaczonych literami A, B, C i D wybierz te, w przebiegu których udział biorą rodniki chloru. Napisz litery, którymi oznaczono te przemiany.
4.2. (0–2)
W reakcjach substytucji elektrofilowej i addycji elektrofilowej bierze udział tzw. elektrofil, czyli
jon lub cząsteczka z niedomiarem elektronów.
Substytucja elektrofilowa w pierścieniu aromatycznym przebiega przez kilka etapów. Najpierw
powstaje nietrwałe połączenie (kompleks π), które następnie przekształca się w karbokation,
tzw. kompleks σ, co wiąże się z deformacją układu wiązań i utratą charakteru aromatycznego.
Po odłączeniu protonu układ wiązań odzyskuje charakter aromatyczny. Opisane etapy
zilustrowano na poniższym schemacie.
Szybkość tworzenia produktu substytucji elektrofilowej zależy od szybkości, z jaką powstaje kompleks σ.
Reakcje addycji elektrofilowej przebiegają także poprzez tworzenie kompleksu π oraz karbokationu, jednak kończą się połączeniem z czynnikiem nukleofilowym, utworzonym w trakcie przemiany.
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
Przykładem reakcji addycji elektrofilowej jest przemiana oznaczona literą (A / B / C / D). W reakcji addycji cząsteczka chloru ulega rozpadowi na kation chloroniowy i anion chlorkowy – wskutek oddziaływania z elektronami wiązania podwójnego. W wyniku działania czynnika elektrofilowego na podwójne wiązanie węglowodoru powstaje, jako produkt przejściowy, organiczny (kation / rodnik), następnie przyłączający jon (Cl+ / Cl–).
Przykładem reakcji substytucji elektrofilowej jest przemiana oznaczona literą (A / B / C / D). W tej przemianie uczestniczy katalizator, który przez utworzenie jonu kompleksowego powoduje rozpad cząsteczki chloru i wytworzenie czynnika elektrofilowego. Tym katalizatorem jest (FeCl3 / H2SO4). W opisanej przemianie najwolniejszym etapem jest ten, w którym (tworzy się kompleks σ / następuje eliminacja protonu).
Zadanie 5. (1 pkt)
W wysokiej temperaturze węgiel reaguje z tlenkiem węgla(IV) i ustala się równowaga chemiczna:
CO2 (g) + C (s) ⇄ 2CO (g)
Objętościową zawartość procentową CO i CO2 w gazie pozostającym w równowadze z węglem w zależności od temperatury (pod ciśnieniem atmosferycznym 1013 hPa) przedstawiono na poniższym wykresie.
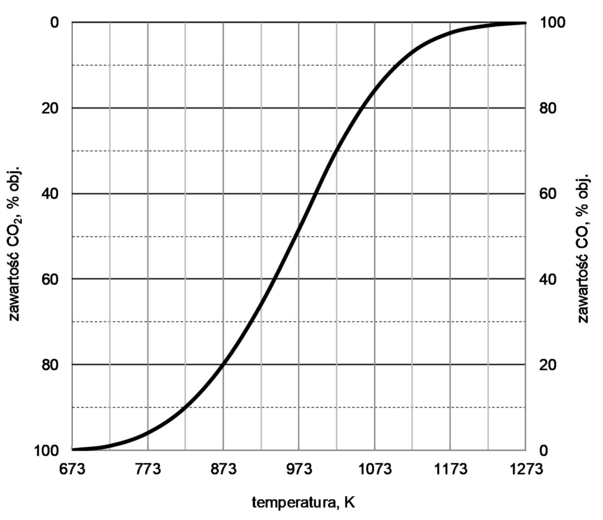
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
Rozstrzygnij, czy reakcja pomiędzy tlenkiem węgla(IV) i węglem jest procesem egzoenergetycznym. Uzasadnij swoją odpowiedź.
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 6. (2 pkt)
W wysokiej temperaturze węgiel reaguje z tlenkiem węgla(IV) i ustala się równowaga chemiczna:
CO2 (g) + C (s) ⇄ 2CO (g)
Objętościową zawartość procentową CO i CO2 w gazie pozostającym w równowadze z węglem w zależności od temperatury (pod ciśnieniem atmosferycznym 1013 hPa) przedstawiono na poniższym wykresie.

Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2004.
W mieszaninie gazów doskonałych sumaryczne stężenie molowe wyraża się wzorem:
c = pR ∙ T
gdzie:
p – ciśnienie w hPa
T – temperatura w K
R – stała gazowa równa 83,1 hPa∙dm3 ∙K–1∙mol–1.
Ponadto
Oblicz wartość stężeniowej stałej równowagi opisanej przemiany w temperaturze 873 K i pod ciśnieniem 1013 hPa. Wyrażenie na stężeniową stałą równowagi tej reakcji przyjmuje postać:
K = [CO]2[CO2]
Załóż, że CO i CO2 są gazami doskonałymi.
Zadanie 7. (1 pkt)
Litowce są metalami miękkimi, a berylowce są od nich nieco twardsze. Ich twardość maleje
w grupie wraz ze wzrostem liczby atomowej pierwiastka. Gęstość litu, sodu i potasu jest mniejsza od gęstości wody, a gęstość rubidu i cezu oraz wszystkich berylowców – większa.
Lit spala się w tlenie do tlenku. Z azotem w temperaturze pokojowej łączy się powoli,
a produktem tej reakcji jest azotek litu Li3N. Z kolei sód spala się w tlenie do nadtlenku sodu,
związku o wzorze Na2O2, w którym tlen występuje na –I stopniu utlenienia.
Magnez, spalany w powietrzu, reaguje nie tylko z tlenem, lecz także z azotem i tlenkiem
węgla(IV).
Na podstawie: K. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007
oraz L. Jones, P. Atkins, Chemia ogólna, Warszawa 2006
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
- Stopień utlenienia tlenu w Na2O2 jest (niższy / wyższy) niż w produkcie spalania litu w tlenie.
- Twardość baru jest (mniejsza / większa) niż twardość cezu.
- Gęstość potasu jest (mniejsza / większa) niż gęstość wapnia.
Zadanie 8. (1 pkt)
Litowce są metalami miękkimi, a berylowce są od nich nieco twardsze. Ich twardość maleje
w grupie wraz ze wzrostem liczby atomowej pierwiastka. Gęstość litu, sodu i potasu jest mniejsza od gęstości wody, a gęstość rubidu i cezu oraz wszystkich berylowców – większa.
Lit spala się w tlenie do tlenku. Z azotem w temperaturze pokojowej łączy się powoli,
a produktem tej reakcji jest azotek litu Li3N. Z kolei sód spala się w tlenie do nadtlenku sodu,
związku o wzorze Na2O2, w którym tlen występuje na –I stopniu utlenienia.
Magnez, spalany w powietrzu, reaguje nie tylko z tlenem, lecz także z azotem i tlenkiem
węgla(IV).
Na podstawie: K. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007
oraz L. Jones, P. Atkins, Chemia ogólna, Warszawa 2006
Napisz w formie cząsteczkowej równania opisanych w informacji przemian.
Spalanie sodu w tlenie:
Reakcja litu z azotem:
Zadanie 9. (2 pkt)
Litowce są metalami miękkimi, a berylowce są od nich nieco twardsze. Ich twardość maleje
w grupie wraz ze wzrostem liczby atomowej pierwiastka. Gęstość litu, sodu i potasu jest mniejsza od gęstości wody, a gęstość rubidu i cezu oraz wszystkich berylowców – większa.
Lit spala się w tlenie do tlenku. Z azotem w temperaturze pokojowej łączy się powoli,
a produktem tej reakcji jest azotek litu Li3N. Z kolei sód spala się w tlenie do nadtlenku sodu,
związku o wzorze Na2O2, w którym tlen występuje na –I stopniu utlenienia.
Magnez, spalany w powietrzu, reaguje nie tylko z tlenem, lecz także z azotem i tlenkiem
węgla(IV).
Na podstawie: K. Lautenschläger, W. Schröter, A. Wanninger, Nowoczesne kompendium chemii, Warszawa 2007
oraz L. Jones, P. Atkins, Chemia ogólna, Warszawa 2006
9.1. (0–1)
W celu otrzymania tlenku magnezu przeprowadzono dwa doświadczenia: I i II. W doświadczeniu I tlenek magnezu otrzymano przez całkowity rozkład MgCO3. W doświadczeniu II tlenek magnezu otrzymano przez spalenie magnezu w powietrzu.
Rozstrzygnij, czy w obu doświadczeniach otrzymano czysty tlenek magnezu. Uzasadnij odpowiedź.
Rozstrzygnięcie:
Uzasadnienie:
9.2. (0–1)
Wyjaśnij, dlaczego palącego się magnezu, czyli tzw. pożarów magnezowych, nie wolno gasić wodą.
Zadanie 10. (3 pkt)
Odważkę czystego węglanu magnezu o masie 8,4 g ogrzewano w piecu nagrzanym do temperatury T, w której ta sól ulega rozkładowi termicznemu – zgodnie z równaniem:
MgCO3 T MgO + CO2
10.1. (0–2)
W czasie ogrzewania węglanu magnezu mierzono w dziesięciominutowych odstępach sumaryczną ilość powstałego gazowego produktu termicznego rozkładu tej soli. Następnie obliczono masę nierozłożonego węglanu magnezu w każdym momencie pomiaru.
Oblicz i wpisz do tabeli brakujące wartości masy (w gramach) nierozłożonego węglanu magnezu zaokrąglone do pierwszego miejsca po przecinku. Następnie narysuj wykres przedstawiający zależność masy węglanu magnezu od czasu prowadzenia jego termicznego rozkładu.
| Czas, minuty | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| Liczba moli CO2, mol | 0,000 | 0,002 | 0,012 | 0,026 | 0,048 | 0,069 | 0,083 | 0,093 | 0,098 |
| Masa MgCO3, g | 8,4 | 8,2 | 6,2 | 4,4 | 2,6 | 0,6 | 0,2 |
10.2. (0–1)
Oceń prawdziwość poniższych zdań. Zaznacz P, jeżeli zdanie jest prawdziwe, albo F − jeśli jest fałszywe.
| 1. | W ciągu pierwszych 40 minut doświadczenia mniej niż połowa użytego węglanu magnezu uległo termicznemu rozkładowi. | P | F |
| 2. | W ciągu pierwszych 70 minut doświadczenia powstało około 3,7 g tlenku magnezu. | P | F |
| 3. | Po upływie 80 minut masa stałej mieszaniny substratu i produktu reakcji była mniejsza o 8,2 g od masy użytej odważki czystego węglanu magnezu. | P | F |
Zadanie 11. (2 pkt)
Przeprowadzono ciąg przemian chemicznych przedstawiony na poniższym schemacie.
11.1. (0–1)
Spośród wymienionych odczynników
- wodorotlenek potasu
- kwas etanowy
- siarczan(VI) baru
- azotan(V) baru
wybierz i wpisz do tabeli nazwy lub wzory tych substancji, które mogły być użyte w poszczególnych etapach opisanego schematem ciągu przemian.
| Numer etapu | 1. | 2. | 3. |
| Nazwa lub wzór użytego odczynnika |
11.2. (0–1)
Napisz w formie jonowej skróconej równania reakcji oznaczonych na schemacie numerami 1. i 2.
Równanie reakcji 1.:
Równanie reakcji 2.:
Zadanie 12. (1 pkt)
Cyjanowodór jest lotną cieczą. Występuje w postaci dwóch izomerycznych odmian, które pozostają ze sobą w równowadze:
cyjanowodór
izocyjanowodór
W temperaturze pokojowej na 99 cząsteczek HCN przypada jedna cząsteczka HNC.
Napisz wzór elektronowy cząsteczki tej izomerycznej odmiany cyjanowodoru, która w temperaturze pokojowej stanowi formę dominującą. Zaznacz kreskami pary elektronowe wiązań chemicznych oraz wolne pary elektronowe. Określ hybrydyzację orbitali walencyjnych atomu węgla w tej cząsteczce.
Wzór elektronowy:
Hybrydyzacja orbitali walencyjnych atomu węgla:
Zadanie 13. (1 pkt)
Cyjanowodór jest lotną cieczą. Występuje w postaci dwóch izomerycznych odmian, które pozostają ze sobą w równowadze:
cyjanowodór
izocyjanowodór
W temperaturze pokojowej na 99 cząsteczek HCN przypada jedna cząsteczka HNC.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Oblicz, ile cząsteczek izocyjanowodoru znajduje się w temperaturze pokojowej w próbce mieszaniny cyjanowodoru i izocyjanowodoru o masie 1,35 g zawierającej obie odmiany w stanie równowagi.
Zadanie 14. (1 pkt)
Cyjanowodór jest lotną cieczą. Występuje w postaci dwóch izomerycznych odmian, które pozostają ze sobą w równowadze:
cyjanowodór
izocyjanowodór
W temperaturze pokojowej na 99 cząsteczek HCN przypada jedna cząsteczka HNC.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, Warszawa 2010.
Cyjanowodór bardzo dobrze rozpuszcza się w wodzie i w niewielkim stopniu ulega dysocjacji jonowej zgodnie z równaniem:
HCN + H2O ⇄ H3O+ + CN–
Wodny roztwór cyjanowodoru nosi nazwę kwasu cyjanowodorowego. W temperaturze 25°C stała dysocjacji tego kwasu K = 6,2 ∙ 10–10.
Na podstawie: CRC Handbook of Chemistry and Physics 97th Edition, CRC Press 2017.
Do probówki zawierającej wodny roztwór wodorowęglanu sodu NaHCO3 wprowadzono – pod wyciągiem – kwas cyjanowodorowy. Przebieg doświadczenia przedstawiono na rysunku.
Rozstrzygnij, czy po wprowadzeniu kwasu cyjanowodorowego do probówki z wodnym roztworem wodorowęglanu sodu zaobserwowano pienienie się zawartości probówki. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 15. (2 pkt)
Do 20 cm3 wodnego roztworu HCl o pH = 1,0 dodano 30 cm3 wodnego roztworu NaOH o stężeniu 0,060 mol∙dm−3. Po zmieszaniu roztworów przebiegła reakcja chemiczna opisana równaniem:
H3O+ + OH– → 2H2O
Wykonaj odpowiednie obliczenia i napisz, ile razy zmalało stężenie jonów hydroniowych H3O+ po dodaniu roztworu NaOH. Przyjmij, że objętość powstałego roztworu jest sumą objętości użytych roztworów.
Stężenie jonów H3O+ zmalało .
Zadanie 16. (2 pkt)
Kwas arsenowy(V) H3AsO4 jest kwasem trójprotonowym o mocy zbliżonej do kwasu ortofosforowego(V). Równowagom, które ustalają się w roztworze wodnym tego kwasu, odpowiadają stałe opisane poniższymi wyrażeniami (podanymi w przypadkowej kolejności), w których została pominięta woda będąca środowiskiem reakcji.
Uszereguj stałe równowagi (wpisz litery A, B oraz C) zgodnie z ich rosnącą wartością. Napisz równanie przemiany, której odpowiada stała równowagi opisana wyrażeniem A. Spośród jonów powstających podczas protolizy (dysocjacji) kwasu arsenowego(V) wybierz i napisz wzór tego, który może pełnić wyłącznie funkcję kwasu Brønsteda.
Równanie reakcji:
Jon, który może pełnić wyłącznie funkcję kwasu Brønsteda:
Zadanie 17. (2 pkt)
W dwóch probówkach znajdowały się wodne roztwory soli X i Z, otrzymane przez rozpuszczenie stałych soli, z których jedną był siarczek potasu, a drugą – bromek potasu. Przeprowadzono doświadczenie zgodnie z poniższym schematem. W doświadczeniu użyto świeżo otrzymanej wody chlorowej.
Po dodaniu wody chlorowej do probówek zauważono, że w probówce I roztwór zmienił barwę, ale pozostał klarowny, natomiast w probówce II pojawiło się zmętnienie.
17.1. (0–1)
Zidentyfikuj sole X i Z i wpisz ich wzory do tabeli.
| Wzór soli X | Wzór soli Z |
|---|---|
17.2. (0–1)
Napisz w formie jonowej skróconej równania reakcji pomiędzy chlorem a bromkiem potasu oraz pomiędzy chlorem a siarczkiem potasu.
Zadanie 18. (3 pkt)
W kolbach oznaczonych numerami I i II znajdowały się dwa różne klarowne roztwory o żółtej barwie. Każdy z roztworów otrzymano przez rozpuszczenie w wodzie jednej substancji wybranej spośród:
Do roztworu w kolbie I dodano wodny roztwór wodorotlenku sodu i zaobserwowano wydzielanie się bezbarwnego gazu o charakterystycznym zapachu. Stwierdzono także, że w mieszaninie nie wytrącił się żaden osad i że roztwór pozostał żółty.
Do roztworu w kolbie II dodano wodny roztwór kwasu siarkowego(VI) i stwierdzono, że roztwór pozostał klarowny, ale zmienił barwę z żółtej na pomarańczową. Kiedy do uzyskanej mieszaniny dodano nadmiar wodnego roztworu wodorotlenku sodu, roztwór z powrotem stał się żółty i nie zaobserwowano wydzielania gazu.
18.1. (0–1)
Spośród wymienionych powyżej związków chemicznych wybierz i napisz wzór związku, którego roztwór znajdował się w kolbie I na początku doświadczenia.
18.2. (0–2)
Napisz w formie jonowej skróconej równanie reakcji, która zaszła w kolbie II:
- po dodaniu wodnego roztworu H2SO4 do zawartości kolby
- po dodaniu nadmiaru wodnego roztworu NaOH.
Zadanie 19. (3 pkt)
Antymon roztwarza się na gorąco w stężonym kwasie siarkowym(VI). W tej przemianie tworzy
się m.in. zdysocjowany w wodnym roztworze siarczan(VI) antymonu(III) oraz wydziela się
bezbarwny gaz o charakterystycznym ostrym zapachu, w którym siarka stanowi 50%
masowych.
Antymon reaguje także na gorąco ze stężonym kwasem azotowym(V). W tej przemianie
wydziela się bezbarwny gaz, który w kontakcie z powietrzem zabarwia się na kolor
czerwonobrunatny, i powstaje trudno rozpuszczalny jednoprotonowy kwas antymonowy(V).
W cząsteczce tego kwasu stosunek liczby atomów wodoru do liczby atomów tlenu jest równy 1 : 3.
19.1. (0–2)
Napisz w formie jonowej z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania reakcji redukcji i utleniania zachodzących podczas opisanego procesu roztwarzania antymonu na gorąco w stężonym kwasie siarkowym(VI). Napisz w formie cząsteczkowej sumaryczne równanie opisanej przemiany.
Równanie reakcji redukcji:
Równanie reakcji utleniania:
Sumaryczne równanie reakcji:
19.2. (0–1)
Napisz w formie jonowej sumaryczne równanie opisanego procesu roztwarzania antymonu na gorąco w stężonym kwasie azotowym(V).
Zadanie 20. (1 pkt)
Na wykresie przedstawiono zależność rozpuszczalności w wodzie dwóch soli – K2CrO4 i Pb(NO3)2 – od temperatury.
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 1997.
Przeprowadzono doświadczenie zilustrowane na poniższym schemacie.
Następnie zawartość zlewek ogrzano do temperatury t, w której w zlewce II cały azotan(V) ołowiu(II) uległ rozpuszczeniu, a otrzymany roztwór był nasycony.
Napisz wartość temperatury t, a następnie uzupełnij poniższe zdanie dotyczące mieszanin otrzymanych w obu zlewkach po ogrzaniu ich zawartości do temperatury t. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
t =
Roztwór w zlewce I jest (nienasycony / nasycony), a jego stężenie wyrażone w procentach masowych jest (mniejsze niż / takie samo jak / większe niż) stężenie roztworu wyrażone w procentach masowych w zlewce II.
Zadanie 21. (2 pkt)
Na wykresie przedstawiono zależność rozpuszczalności w wodzie dwóch soli – K2CrO4 i Pb(NO3)2 – od temperatury.
Do 100 gramów nasyconego roztworu azotanu(V) ołowiu(II) o temperaturze 32°C dodano 100 gramów nasyconego roztworu chromianu(VI) potasu o temperaturze 32°C. W wyniku przemiany zilustrowanej poniższym równaniem wytrącił się osad.
Pb2+ + CrO2–4 → PbCrO4
Oblicz masę otrzymanego osadu. Wskaż substancję użytą w nadmiarze – podaj jej wzór lub nazwę. Przyjmij, że opisana przemiana przebiegła z wydajnością równą 100%. Masy molowe są równe: MK2CrO4 = 194 g∙mol–1, MPb(NO3)2 = 331 g∙mol–1, MPbCrO4 = 323 g∙mol–1 .
Masa osadu: .
W nadmiarze użyto .
Zadanie 22. (2 pkt)
W dwóch nieoznaczonych probówkach znajdowały się oddzielnie: rozcieńczony wodny roztwór kwasu azotowego(V) i rozcieńczony wodny roztwór kwasu siarkowego(VI). W tych roztworach zanurzono blaszki miedziane, a zawartość probówek lekko ogrzano.
Po zanurzeniu blaszki miedzianej w roztworze kwasu X i ogrzaniu zawartości probówki wydzielał się bezbarwny gaz, który w kontakcie z powietrzem zabarwiał się na kolor czerwonobrunatny.
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
W rozcieńczonym roztworze kwasu azotowego(V) miedź (reaguje z wydzieleniem gazowego tlenku / reaguje z wydzieleniem wodoru / nie reaguje) i roztwór (przyjmuje barwę niebieską / pozostaje bezbarwny). W rozcieńczonym roztworze kwasu siarkowego(VI) miedź (reaguje z wydzieleniem gazowego tlenku / reaguje z wydzieleniem wodoru / nie reaguje) i roztwór (przyjmuje barwę niebieską / pozostaje bezbarwny). Kwasem X jest (HNO3 / H2SO4).
Zadanie 23. (1 pkt)
Alkany można otrzymać z halogenków alkilów o ogólnym wzorze R–X, w którym R oznacza grupę alkilową, a X – atom halogenu (chloru, bromu lub jodu). Halogenki alkilów reagują z sodem zgodnie z poniższym schematem:
2R–X + 2Na T R–R + 2NaX
Reakcję przeprowadza się w środowisku bezwodnym w podwyższonej temperaturze. Jeżeli do reakcji zastosuje się jeden halogenek alkilu, R–X, otrzymuje się jeden alkan, a przy zastosowaniu różnych halogenków alkilów, np. R1–X i R2–X, powstaje mieszanina alkanów.
Na podstawie: R.T. Morrison, R.N. Boyd, Chemia organiczna, Warszawa 2008.
Pewien jodek alkilu poddano działaniu sodu i otrzymano alkan o wzorze:
Napisz wzór półstrukturalny (grupowy) i nazwę systematyczną jodku alkilu, który poddano działaniu sodu w opisanej reakcji.
Wzór półstrukturalny (grupowy):
Nazwa systematyczna:
Zadanie 24. (1 pkt)
Alkany można otrzymać z halogenków alkilów o ogólnym wzorze R–X, w którym R oznacza grupę alkilową, a X – atom halogenu (chloru, bromu lub jodu). Halogenki alkilów reagują z sodem zgodnie z poniższym schematem:
2R–X + 2Na T R–R + 2NaX
Reakcję przeprowadza się w środowisku bezwodnym w podwyższonej temperaturze. Jeżeli do reakcji zastosuje się jeden halogenek alkilu, R–X, otrzymuje się jeden alkan, a przy zastosowaniu różnych halogenków alkilów, np. R1–X i R2–X, powstaje mieszanina alkanów.
Na podstawie: R.T. Morrison, R.N. Boyd, Chemia organiczna, Warszawa 2008.
Mieszaninę 2-jodobutanu i jodku metylu poddano działaniu sodu i otrzymano różne alkany.
Oceń prawdziwość poniższych zdań. Zaznacz P, jeżeli zdanie jest prawdziwe, albo F − jeśli jest fałszywe.
| 1. | W opisanej reakcji otrzymano cztery różne alkany. | P | F |
| 2. | Otrzymanym w opisanej reakcji alkanem o najmniejszej masie cząsteczkowej był metan. | P | F |
| 3. | Alkanem o największej masie cząsteczkowej – otrzymanym w opisanej reakcji – był 3,4-dimetyloheksan. | P | F |
Zadanie 25. (2 pkt)
W wyniku zasadowej hydrolizy 2-jodobutanu otrzymano alkohol, który następnie utleniono tlenkiem miedzi(II).
25.1. (0–1)
Uzupełnij schemat opisanych przemian. Wpisz wzory półstrukturalne (grupowe): 2-jodobutanu, alkoholu otrzymanego w wyniku zasadowej hydrolizy 2-jodobutanu i organicznego produktu utlenienia tlenkiem miedzi(II) tego alkoholu.
2-jodobutan
alkohol
produkt utlenienia alkoholu
25.2. (0–1)
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
Hydroliza zasadowa jodku alkilu jest reakcją (addycji / substytucji / eliminacji) zachodzącą zgodnie z mechanizmem nukleofilowym. Przykładem obojętnego elektrycznie nukleofilu jest cząsteczka (CH4 / H2 / NH3), a nukleofilu jonowego – jon (CN– / Cu2+ / H3O+).
Zadanie 26. (2 pkt)
Alkeny można otrzymać m.in. w wyniku reakcji eliminacji wody z alkoholi (tzw. reakcja dehydratacji alkoholi).
Poddano dehydratacji 3-metylobutan-2-ol i otrzymano mieszaninę alkenów A i B, przy czym alken A jest produktem głównym (atom wodoru jest odrywany w tym przypadku od tego atomu węgla, który jest połączony z mniejszą liczbą atomów wodoru), a alken B – produktem ubocznym przemiany.
26.1. (0–1)
Produkt A można także otrzymać w wyniku dehydratacji innego alkoholu.
Podaj wzór półstrukturalny (grupowy) i nazwę systematyczną tego alkoholu.
| Wzór: | Nazwa systematyczna: |
| |
26.2. (0–1)
Napisz równanie reakcji alkenu A z bromowodorem (HBr) prowadzącej do powstania produktu głównego tej przemiany. Zastosuj wzory półstrukturalne (grupowe) związków organicznych.
Zadanie 27. (2 pkt)
Poniżej przedstawiono wzory dwóch związków organicznych: mentolu i tymolu.
Uzupełnij poniższe tabele.
- Określ hybrydyzację orbitali walencyjnych: atomu węgla oznaczonego we wzorze mentolu literą a oraz atomu węgla oznaczonego we wzorze tymolu literą x.
| Atom węgla | a | x |
| hybrydyzacja |
- Określ formalne stopnie utlenienia: atomu węgla oznaczonego we wzorze mentolu literą b oraz atomu węgla oznaczonego we wzorze tymolu literą y.
| Atom węgla | b | y |
| stopień utlenienia |
Zadanie 28. (1 pkt)
Poniżej przedstawiono wzory dwóch związków organicznych: mentolu i tymolu.
Rozstrzygnij, czy cząsteczka tymolu jest chiralna. Odpowiedź uzasadnij.
Rozstrzygnięcie:
Uzasadnienie:
Zadanie 29. (1 pkt)
Do 500 cm3 wodnego roztworu kwasu metanowego (mrówkowego) o stężeniu 1 mol ∙ dm−3 dodano 500 cm3 wody. Temperatura otrzymanego roztworu nie uległa zmianie.
Dokończ zdanie. Zaznacz odpowiedź wybraną spośród A–C oraz odpowiedź wybraną spośród 1.–3.
Należy wnioskować, że po dodaniu wody do wodnego roztworu kwasu metanowego
| wartość stałej dysocjacji |
A. | wzrosła, | a wartość stopnia dysocjacji | 1. | wzrosła. |
| B. | zmalała, | 2. | zmalała. | ||
| C. | nie uległa zmianie, | 3. | nie uległa zmianie. |
Zadanie 30. (2 pkt)
Reakcja estryfikacji, w której uczestniczą kwas etanowy i butan-2-ol, zachodzi w środowisku kwasowym zgodnie z równaniem:
W temperaturze T stężeniowa stała równowagi tej reakcji Kc = 2,12.
Na podstawie: Estryfikacja, https://tsl.wum.edu.pl [dostęp 09.01.2020]
Oblicz, ile gramów bezwodnego kwasu etanowego należy użyć do reakcji z jednym molem butan-2-olu w temperaturze T, aby przereagowało 85% początkowej ilości butan-2-olu.
Zadanie 31. (1 pkt)
Reakcja estryfikacji, w której uczestniczą kwas etanowy i butan-2-ol, zachodzi w środowisku kwasowym zgodnie z równaniem:
W temperaturze T stężeniowa stała równowagi tej reakcji Kc = 2,12.
Na podstawie: Estryfikacja, https://tsl.wum.edu.pl [dostęp 09.01.2020]
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
Przy użyciu w opisanej reakcji równomolowej mieszaniny kwasu i alkoholu wydajność tej
reakcji jest w temperaturze T (niższa niż / równa / wyższa od) 85%.
Opisaną reakcję przeprowadza się w środowisku kwasowym, ponieważ jony H+
(katalizują tę reakcję / zwiększają wydajność tej reakcji).
W środowisku zasadowym opisany ester ulega hydrolizie, której produktami są butan-2-ol
i (kwas etanowy / sól kwasu etanowego).
Zadanie 32. (1 pkt)
Cząsteczki kwasu etanowego mogą tworzyć dimer:
Dimer ten występuje w stanie gazowym oraz w roztworach kwasu etanowego w rozpuszczalnikach nietworzących z nim wiązań wodorowych.
Uzupełnij poniższe zdania. Wybierz i podkreśl jedną odpowiedź spośród podanych w każdym nawiasie.
Przedstawiony w informacji dimer powstaje w wyniku tworzenia się wiązań (kowalencyjnych / jonowych / wodorowych) między cząsteczkami kwasu etanowego. Rozcieńczony roztwór kwasu etanowego w wodzie (nie zawiera dimerów / zawiera dimery), ponieważ woda (nie tworzy wiązań wodorowych / tworzy wiązania wodorowe) z cząsteczkami kwasu etanowego.
Zadanie 33. (2 pkt)
W dwóch probówkach (I, II) znajdowały się wodne roztwory dwóch substancji wybranych spośród następujących:
W celu ich identyfikacji przeprowadzono opisane poniżej doświadczenia.
- Do próbek pobranych z probówek I i II dodano kwas solny, ale w żadnym naczyniu nie zaobserwowano zmian.
- Z probówek I i II pobrano próbki i wprowadzono do nich wodny roztwór oranżu metylowego. Otrzymano roztwory o różnych barwach. W naczyniu z próbką pobraną z probówki I roztwór przyjął barwę czerwoną.
33.1. (0–1)
Podaj nazwy lub wzory związków, które zidentyfikowano podczas przeprowadzonych doświadczeń.
Probówka I:
Probówka II:
33.2. (0–1)
Napisz w formie jonowej skróconej równanie reakcji, która decyduje o odczynie wodnego roztworu substancji znajdującej się w probówce I.
Zadanie 34. (2 pkt)
Próbkę pewnego tripeptydu o masie 43,4 mg poddano całkowitej hydrolizie w stężonym kwasie solnym. Po odparowaniu uzyskanego roztworu do sucha otrzymano mieszaninę związków jonowych o wzorach:
Uzyskaną w opisany sposób mieszaninę rozpuszczono w wodzie i dodano do niej nadmiar
wodnego roztworu azotanu(V) srebra. Zaszła wtedy reakcja opisana równaniem:
Ag+ + Cl– → AgCl.
Wytrącony osad AgCl odsączono, wysuszono i zważono. Jego masa była
równa 86,1 mg.
Określ, z ilu reszt glicyny x i z ilu reszt alaniny y składała się jedna cząsteczka badanego tripeptydu. Napisz wzór tripeptydu w postaci Glyx Alay . Przyjmij masę molową chlorku srebra MAgCl = 143,5 g ∙ mol–1.
Wzór tripeptydu:
Zadanie 35. (1 pkt)
W wyniku kondensacji z jednej cząsteczki cysteiny (Cys) i dwóch cząsteczek leucyny (Leu) mogą powstać różne tripeptydy.
Napisz wszystkie możliwe sekwencje aminokwasów w tripeptydach o budowie liniowej – zastosuj trzyliterowe kody aminokwasów.
Sekwencje aminokwasów w tripeptydach:
Zadanie 36. (2 pkt)
Do czterech probówek zawierających niebieską zalkalizowaną zawiesinę świeżo strąconego wodorotlenku miedzi(II) wprowadzono bezbarwne wodne roztwory czterech różnych związków – do każdej probówki roztwór innej substancji. Zawartość każdej probówki wymieszano. Przebieg doświadczenia zilustrowano na poniższym rysunku.
Rozstrzygnij, czy zmiany zaobserwowane podczas doświadczenia umożliwiają potwierdzenie, że do danej probówki wprowadzono roztwór wskazany na rysunku. Odpowiedź uzasadnij. W uzasadnieniu opisz możliwe do zaobserwowania zmiany zawartości probówek, uwzględnij rodzaj (roztwór, zawiesina) oraz barwę mieszaniny otrzymanej po dodaniu roztworu danej substancji do każdej probówki.
Rozstrzygnięcie:
Uzasadnienie:
Probówka I:
Probówka II:
Probówka III:
Probówka IV:
