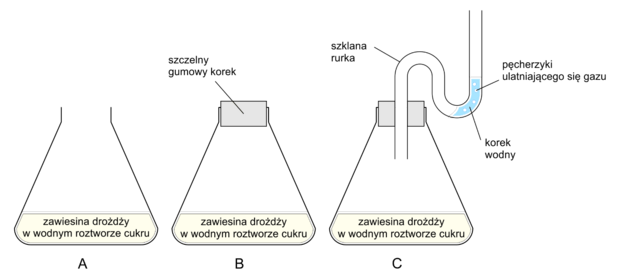
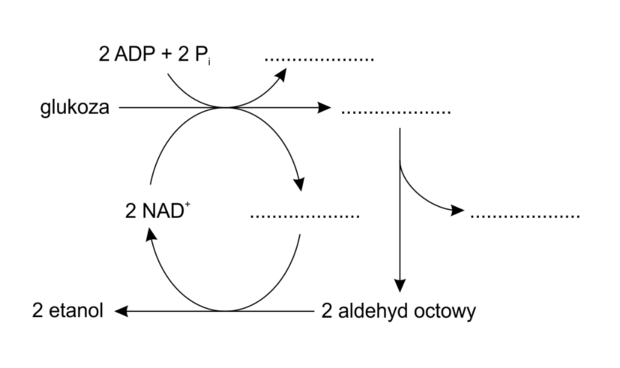
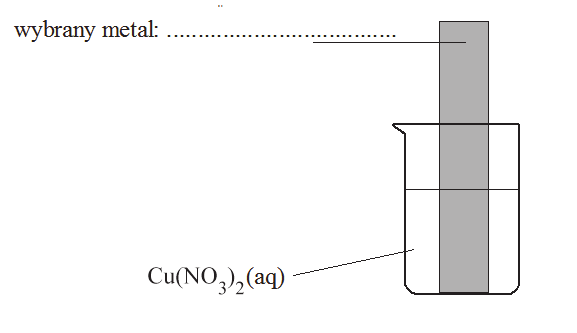
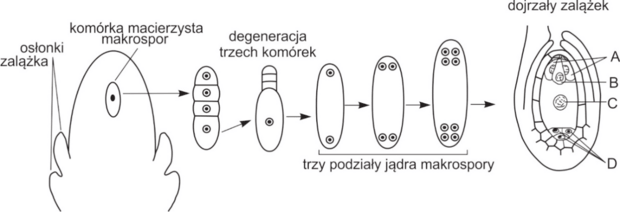
Informator CKE, Poziom rozszerzony (Formuła 2023) - Zadanie 10. (3 pkt)
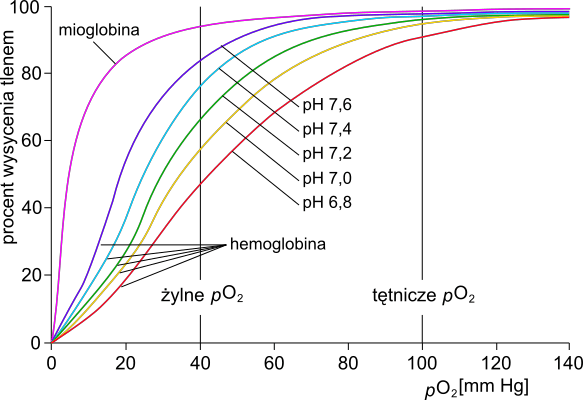
Mioglobina jest białkiem występującym w mięśniach kręgowców. U ssaków nurkujących służy jako magazyn tlenu: pozwala na pracę mięśni w warunkach chwilowego niedotlenienia całego organizmu. Natomiast obecność mioglobiny w mięśniach pozostałych ssaków przede wszystkim wpływa na efektywność dyfuzji tlenu z krwi do mięśni.
Na poniższym wykresie przedstawiono powinowactwo mioglobiny do tlenu oraz powinowactwo hemoglobiny do tlenu w pięciu różnych pH.
J.M. Berg, J.L. Tymoczko, L. Stryer, Biochemia, Warszawa 2009, s. 183–193.
10.1. (0–1)
Określ, jaki wpływ na dyfuzję tlenu z krwi do włókien mięśniowych ma mioglobina występująca w cytozolu tych komórek. Odpowiedź uzasadnij, odnosząc się do danych przedstawionych na wykresie.
10.2. (0–1)
Uzupełnij poniższe zdanie tak, aby w poprawny sposób opisywało ono procesy wymiany gazowej zachodzące w płucach człowieka. W każdym nawiasie podkreśl właściwe określenie.
Podczas wymiany gazowej w płucach człowieka dyfuzja CO2 z krwi do pęcherzyków płucnych jest przyczyną (wzrostu / spadku) pH krwi, a dzięki temu następuje (wzrost / spadek) powinowactwa hemoglobiny do tlenu.
10.3. (0–1)
Uzupełnij poniższy schemat tak, aby poprawnie ilustrował drogę tlenu z powietrza pęcherzykowego, aż do jego wykorzystania w procesie tlenowego oddychania wewnątrzkomórkowego. Wpisz we właściwe miejsca wymienione poniżej nazwy.
tlen cząsteczkowy → → →