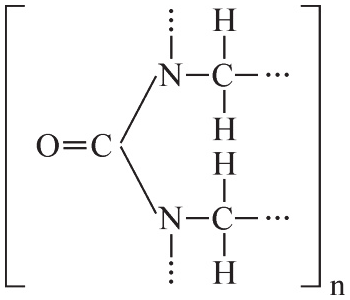
Biomedica 2022, Poziom rozszerzony (Formuła 2015) - Zadanie 28. (3 pkt)
Przeprowadzono doświadczenie zilustrowane poniższym schematem:
Przeanalizuj przedstawione doświadczenie, a następnie wykonaj poniższe polecenia.
28.1. (0-1)
Napisz przewidywane obserwacje dla probówki 1. i 2.
Probówka 1.:
Probówka 2.:
28.2. (0-1)
Na podstawie przeprowadzonego doświadczenia sformuj wniosek dla probówki 1. i 2.
Probówka 1.:
Probówka 2.:
28.3. (0-1)
Zapisz równanie reakcji w formie jonowej skróconej, która zaszła w probówce 2.